 Dieser Artikel ist Teil einer fortlaufenden Besprechung des Buchs “Stuff Matters: Exploring the Marvelous Materials That Shape Our Man-Made World”* von Mark Miodownik. Jeder Artikel dieser Serie beschäftigt sich mit einem anderen Kapitel des Buchs. Eine Übersicht über alle bisher erschienenen Artikel findet man hier.
Dieser Artikel ist Teil einer fortlaufenden Besprechung des Buchs “Stuff Matters: Exploring the Marvelous Materials That Shape Our Man-Made World”* von Mark Miodownik. Jeder Artikel dieser Serie beschäftigt sich mit einem anderen Kapitel des Buchs. Eine Übersicht über alle bisher erschienenen Artikel findet man hier.
In den bisherigen Kapiteln haben wir schon viele verschiedene Materialien kennengelernt: Stahl, Papier, Beton, Schokolade, Aerogel, Plastik und Glas. Aber in Kapitel 8 treffen wir auf ein Material, dass fast so vielfältig ist wie all die vorangegangenen Stoffe zusammen: Graphit!
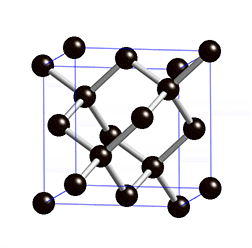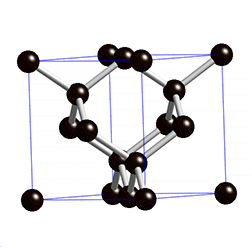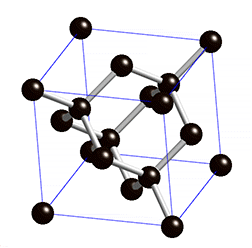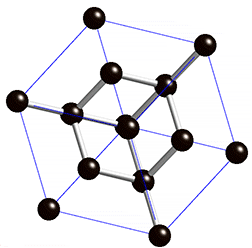
Oder eigentlich Kohlenstoff, den nichts anderes ist Graphit ja. Kohlenstoff ist ein Atom, dessen Kern aus sechs Protonen und sechs Neutronen besteht (radioaktive Isotope ignorieren wir mal). Aber für seine besonderen Eigenschaften sind die sechs Elektronen in der Hülle des Atoms verantwortlich. Zwei davon befinden sich weit innen und spielen keine Rolle. Aber in der äußeren Hülle hat Kohlenstoff vier Elektronen die frei sind, sich an andere Atome zu binden. Diese große Freiheit macht den Kohlenstoff so außergewöhnlich; er kann sich auf viele verschiedenen Arten mit vielen anderen Elementen oder anderen Kohlenstoffatomen verbinden. Wenn ein Kohlenstoffatom jedes der vier freien Elektronen mit jeweils einem anderen Kohlenstoffatom teilt, dann entsteht ein dreidimensionaler, komplett regelmäßiger Kristall. Jedes Elektron hängt an einem anderen Atom fest; alle sind miteinander verbunden und man bekommt eine extrem harte Struktur: einen Diamanten.

Aus der simplen Anordnung der Atome (oben) wird ein beeindruckender Diamant (unten) (Bilder: gemeinfrei)
Damit sich Kohlenstoff aber in dieser Form anordnet, braucht es viel Energie. Energie, die normalerweise nur tief im Inneren der Erde vorkommt, wo hohe Temperaturen und hoher Druck die glitzernden Kristalle formen die durch tektonische und vulkanische Aktivitäten irgendwann an die Oberfläche gelangen. Miodownik beschreibt in Kapitel 8, wie die immer intensivere Förderung von Diamanten die gesamte Gesellschaft beeinflusst hat, inklusive von Filmen und Literatur. Er erklärt auch, warum sich Diamanten – im Gegensatz zu Gold – nie als Währung durchgesetzt haben (ist eigentlich ganz logisch und ich bin sicher, dass ihr da auch von selbst drauf kommt 😉 ).
Sehr interessant fand ich die Erklärungen zur Stabilität von Diamanten. “Diamonds are forever” heißt es zwar in einem bekannten Lied, aber dem ist nicht so. Graphit ist eine stabilere Anordnung der Kohlenstoffatome als die Diamantkristalle und deswegen will sich ein Diamant im Laufe der Zeit wieder zu Graphit transformieren (und deswegen braucht es auch so viel Energie, um Kohlenstoff in die für ihn unangenehme Diamantstruktur zu pressen). Bei Graphit sind die Atome in einem hexagonalen Gitter verbunden. Hier teilt sich jedes Atom seine vier Elektronen drei Nachbaratomen. Das ist eine feste und extrem stabile Verbindung, aber nur wenn sich die Atome auch in der gleichen Ebene befinden. Graphit besteht aus vielen übereinander geschichteten Lagen aus miteinander verbundenen Kohlenstoffatome. Jede einzelne Lage ist enorm stabil – aber die Lagen untereinander werden nicht durch Bindungen zwischen den Atomen selbst zusammen gehalten sondern nur durch die viel schwächere Van-der-Waals-Kraft, die durch die elektrischen Felder der Moleküle erzeugt wird. Deswegen ist es enorm leicht die Atomlagen zu verschieben: Wenn man mit einem Bleistift schreibt, dann passiert genau das. Der Druck auf dem Papier reicht aus um die Van-der-Waals-Kraft zu überwinden und ein paar Lagen Graphit vom Stift auf das Papier zu transferieren.
Miodownik hat noch viel über die verschiedenen anderen Konfigurationen des Kohlenstoffs zu erzählen. Über Kohle und Gagat und den Einfluss der Schmuckmode auf die britische Wirtschaft. Auch die Geschichten über Antoine Lavoisier der Diamanten verbrannte und in Graphit umwandelte und damit ein Wettrennen um die Suche nach der Umkehrung dieses Prozess verursachte, ist interessant. Ich fand aber vor allem die Entdeckung von Lonsdaleit spannend. Dieser “hexagonale Diamant” ist noch härter als ein Diamant und wurde im Einschlagskrater eines Meteoriten entdeckt. Die extremen Temperaturen und Drücke haben Graphit in diese spezielle Form des Kohlentstoffs transferiert. Neue Forschungsergebnisse (von denen Miodownik bei Publikation seines Buchs nichts wissen konnte) zeigen aber nun, dass es vielleicht doch keine spezielle Struktur ist, sondern vielleicht einfach nur ein “fehlerhafter” Diamant. Egal – denn mittlerweile hat man sowieso ein noch stabileres Material gefunden: Carbonfaser. Dafür wird Graphit in Fasern versponnen und zu einer Art Stoff verwebt, die mit Kunststoff verstärkt werden. Dieses Material ist leichter und dabei härter als anderen und hat die Konstruktion von allen möglichen Gerätschaften – vom Flugzeug bis zum Tennisschläger – revolutioniert.

Science-Fiction mit Kohlenstoff? So könnte ein Weltraumlift aussehen (Bild: NASA)
Aber Kohlenstoff kann vielleicht noch mehr. Natürlich kommt Miodownik in diesem Kapitel auch auf den Weltraumlift zu sprechen. Was das ist und warum so ein Ding toll wäre, habe ich hier und hier erklärt. Kurz gesagt: Ein Weltraumlift wäre eine direkte Verbindung von der Erde ins Weltall, würde die Raumfahrt billiger und einfacher machen und uns all die Dinge ermöglichen, die wir nur aus Science-Fiction-Filmen kennen. Aber damit der Lift funktioniert, braucht es ein Material das fester und leichter ist als alles, was wir zur Verfügung haben. Eine mögliche Lösung könnten Kohlenstoffnanoröhren sein. Das sind im Prinzip einzelne Graphit-Lagen, die zu einer Röhre aufgerollt sind. Diese Röhre wird jetzt komplett von den starken Bindungen zwischen den Atomen zusammengehalten und wäre stabil genug, um als Material für einen Weltraumlift zu dienen. Leider sind die Röhren die man derzeit konstruieren kann, bei weitem noch nicht lang genug – aber wer weiß: Vielleicht gelingt den Materialwissenschaftlern ja bald der Durchbruch.
Es ist schon ein wenig seltsam, wenn man darüber nachdenkt, dass das Material, mit dem wir auf einem Notizblock herumkritzeln das gleiche ist, das uns den Weg zu den Sternen öffnen könnte. Und das der Unterschied nur in der Anordnung der Atome besteht. Aber das ist auch mein Fazit des Kapitels und vermutlich auch das, was Miodownik hier vermitteln wollte (er spricht übrigens auch noch ausführlich über Graphene und diverse andere Materialien): In der Welt der Materialien kommt es nicht nur darauf an, aus was etwas besteht, sondern auch wie man die Einzelteile zusammenfügt. Das gilt für Ikea-Möbel genau so wie für einzelne Atome…*Affiliate-Links











Kommentare (5)