Hinweis: Dieser Artikel ist ein Beitrag zum ScienceBlogs Blog-Schreibwettbewerb 2015. Hinweise zum Ablauf des Bewerbs und wie ihr dabei Abstimmen könnt findet ihr hier. Informationen über die Autoren der Wettbewerbsbeiträge findet ihr jeweils am Ende der Artikel.

——————————————
Chemie ist alles und doch die Lehre des scheinbaren Nichts.
Während Physik der Baseballschläger sichtbar macht, Biologie und Co bei jedem Toilettengang sichtbar wird und beim Blick in den Sternenhimmel schon so mancher Astronom geboren wurde fristet die Chemie ein Schattendasein. Chemie teilt die Menschen oftmals in zwei Kategorien. Da sind die einen, die die Orbitale verehren und die anderen die bei der bloßen Erwähnung von Atomen Schüttelfrost bekommen.
Dabei bilden Atome die Basis aller Materie. Um sich aufzumachen den Mikro- und Makrokosmos rund um unser bescheidenes Dasein zu erforschen, sollte man stets ein gut sortiertes Basiswissen Chemie im Rucksack haben.
Die Chemie beschäftigt sich mit den Elementen und den unzähligen Verbindungen die diese bilden. Und diese Elemente sind überall.
Unser Körper, der Tisch an dem du sitzt, die Erde – jede Materie besteht aus Elementen.
Blickst du gerade auf einen Computerbildschirm? Silicium und Sauerstoff sind hierbei die überwiegenden Bausteine des Displays und Kohlenstoff und Wasserstoff wesentliche Bestandteile des Kunststoffrahmens.
Der Tag war schon lange? Einmal tief durchatmen! Und Schwupps sind schon Unmengen an Sauerstoff, Stickstoff und Argon auf dem Weg in deine Lunge.
Doch woher kommen all diese Elemente aus denen scheinbar alles um uns herum besteht?
Die Entstehung liegt schon einige Zeit zurück und geschieht doch laufend in den Weiten des Alls. Eben gerade jetzt entstehen Unmengen Tonnen an Material für neue Erden.
Um das zu verstehen betrachten wir kurz den Begriff des Elements.
Zerlegt man die Stoffe unserer Umwelt durch chemische (z.B. verbrennen) oder physikalische (z.B. zerbrechen) Verfahren, so gelangt man stets zu Bestandteilen, die sich nicht mehr in weitere Stoffe zerlegen lassen, ohne ihre stofflichen Eigenschaften zu verlieren. Diese übriggebliebenen Stoffe werden als Elemente bezeichnet.
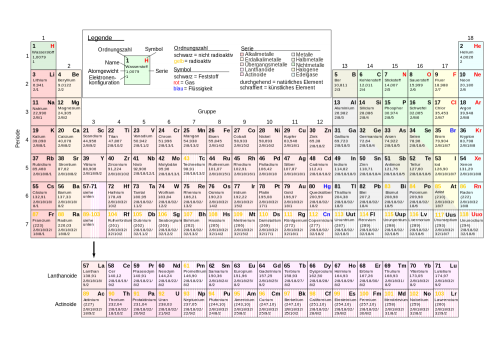
In der Natur kommen 92 Elemente vor. Absolute Bio-Elemente sozusagen. Dabei handelt es sich um Stoffe wie Aluminium, Sauerstoff, Eisen, Helium, Kohlenstoff, Schwefel usw.
Alle Elemente, manche wurden auch künstlich hergestellt, findet man in einem eigenen Katalog, in dem auch noch diverse Eigenschaften zu den einzelnen Stoffen vermerkt sind. Diesen Katalog nennt man Periodensystem.
Doch auch die Elemente bestehen aus kleinen Bausteinen.
Diese kleinsten Teilchen eines Elements die noch dessen Eigenschaften besitzen bezeichnet man als Atome. Die sind aber so unglaublich winzig, dass sie mit freiem Auge nur für so manchen Superhelden sichtbar sind.
Stell dir vor du hältst eine Handvoll Nägel aus dem Element Eisen. Dann befinden sich aus einer anderen Perspektive gesehen 100 000 000 000 000 000 000 000, also 1023, Eisenatome in deiner Hand. Dicht an dicht gereiht und auf ihre eigene Art verbunden bilden diese Atome, die man sich als kleine Kugeln vorstellen kann, die für uns sichtbaren Nägel.
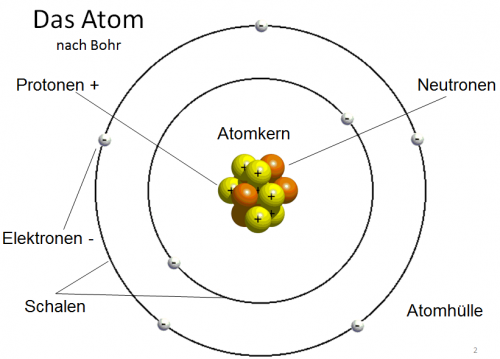
Ein Atom wiederum besteht aus einem Kern und Schalen. Im vereinfachten sogenannten Bohrschen Atommodell stellt man sich den Kern im Zentrum vor, dieser wiederum besteht aus Protonen (positiv geladene Teilchen) und Neutronen (neutrale Teilchen). Dieser Kern wird wie die Sonne von den Planeten, von seinen Elektronen umkreist (negativ geladene Teilchen).
Die Atome eines bestimmten Elementes haben alle die gleiche Anzahl an Protonen. Wasserstoff hat immer ein Proton im Kern, Helium hat zwei Protonen im Kern und so weiter. Würde Helium ein Proton aus seinem Kern durch eine kleine Unachtsamkeit verlieren, wäre es nicht mehr Helium sondern Wasserstoff.
Ein Atom hat im „Normalzustand“ gleich viele Elektronen wie Protonen. Das heißt gleich viel + wie -. Diese Elektronen können in bis zu sieben Schalen aufgeteilt werden.
Das einfachste Element ist demnach Wasserstoff. Es besitzt nur ein Proton in seinem Kern und dieser wird von einem Elektron umkreist. Soweit so gut.
Aber zurück zum Anfang und der Frage wo die 92 Bio-Elemente jetzt eigentlich herkommen?
Am Anfang war ja nichts los. Das dafür aber nirgends und nie.
Dann brach die Hölle los. Die Uhr begann zu ticken und man hatte Platz eine aufzuhängen. Nach der anfänglichen Verwirrtheit bei ungemütlich hohen Temperaturen (also nach ca. 3min) kühlte das Universum auf für Atombestandteile erträgliche 1 Milliarde Kelvin ab.
Bei dieser Temperatur begannen die inzwischen durch die Gegend schwirrenden Protonen und Neutronen einfache Atomkerne zu bilden. Ca. 70% Deuterium und der Rest Helium, sowie Spuren von Lithium (ein Element, dessen Atome im Kern 3 Protonen aufweisen). Ansonsten lungerten noch einige Elektronen im expandierenden Raum herum. Die Situation war ihnen aber noch zu heiß um sich den Atomkernen zu nähern. Gut prüfe wer sich ewig bindet und daher dauerte es noch mal 700 000 Jahre bis sich die Elektronen und die Wasserstoff-, Helium- und Lithiumkerne zu vollwertigen Atomen verbanden.
Wer mitgezählt hat wird feststellen, dass uns noch 89 Elemente fehlen.
Doch jetzt geht’s erst so richtig los.
Die Anziehungskräfte untereinander und Unregelmäßigkeiten in der Verteilung der entstandenen Materie führten dazu, dass sich „Gasklumpen“ bildeten die immer schwerer wurden bis der Druck und die Temperatur in diesen Ansammlungen dazu führte, dass die Wasserstoffatome so stark zusammengedrückt wurden, dass vereinfacht gesagt aus sechs Wasserstoffatomen zwei Heliumatome entstanden. Doch damit nicht genug. Hätte man die beiden Wasserstoffatome vor dem Verschmelzen auf eine Waage gelegt und die Masse mit dem Heliumatom nach der Verschmelzung verglichen, hätte man festgestellt, dass bei dem Vorgang Masse verloren ging. Doch das Weltall verliert nichts. Die Masse wurde in Energie umgewandelt. Und das Ganze sieht dann ungefähr so aus:
Richtig, es handelt sich um eine Sonne und aufgrund der frei werdenden Energie, der hohen Masse und der hohen Temperaturen kommt es zu weiteren Verschmelzungen der verschiedenen Atomkerne, man nennt diesen Prozess Kernfusion. Unsere Sonne fusioniert in jeder Sekunde etwa 700.000.000 Tonnen Wasserstoff zu circa 695.000.000 Tonnen Helium.
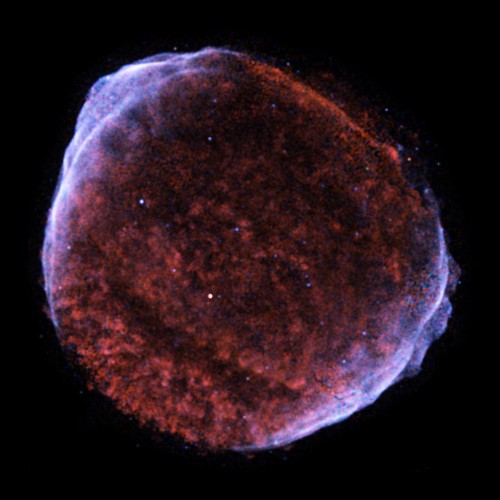
So entsteht in jeder Sonne laufend sehr viel Energie und es bilden sich neue Elemente. Kernfusion in Sonnen funktioniert aber nur bis zu Eisen. Also bis zu Kernen mit 26 Protonen. Der Rest der Truppe bis 92 (also mit 92 Protonen im Kern) entsteht in Roten Riesen (in der letzten Entwicklungsstufe massereicher Sterne) und wenn ein Stern explodiert, sogenannten Supernovae. Etwa hier:
Einst bildete sich aus solchem Staub unsere Sonne, unsere Erde und schlussendlich entstanden du und ich. Jedes Atom Kohlenstoff, Sauerstoff und all die anderen Atome die uns formen, waren einst Teil einer Sonne.
Waren Sternenstaub.
Aber wie genau muss man welche Elemente aneinanderreihen um einen Menschen oder den Duft eines Veilchens zu erleben, Schokolade zu schmecken oder durch Hormone Liebe zu empfinden?
Doch das ist eine andere Geschichte und soll ein andermal erzählt werden.
————————————————-
Hinweis zum Autor: Michael Weinberger unterrichtet als Ausbilder für Lehrlinge und Erwachsene im Bereich Chemieverfahrenstechnik unter anderem Chemie und versucht tagtäglich die weit verbreitete Abneigung gegen diese wunderbare Wissenschaft aus den Köpfen der Menschen zu vertreiben und die Faszination die er selbst dafür empfindet in anderen zu wecken.













Kommentare (31)