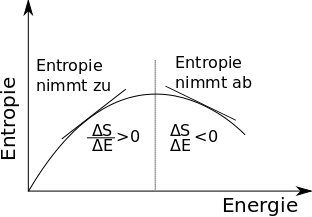
Die Änderung der Entropie mit der Energie ist nichts als die Steigung der Kurve. Anfänglich ist sie groß, die Temperatur ist also niedrig, weil sie ja der Kehrwert der Änderung ist. Später wird die Steigung immer flacher, die Temperatur wird also größer. Dann, genau an der gestrichelten Linie, hat die Entropie ein Maximum. Hier ist die Steigung gleich Null, die Temperatur ist unendlich groß, Und dann wird die Steigung negativ. Direkt hinter dem Maximum ist sie negativ, aber sehr flach, die Temperatur ist also negativ, hat aber einen hohen Betrag. Das System springt also von der Temperatur plus unendlich zu minus unendlich. Fügt man weitere Energie zu, wird die Steigung steiler, der Betrag der Temperatur sinkt also, sie nimmt von minus unendlich aus immer größere Werte (also solche mit kleinerem Betrag) an.
Man erreicht also negative Temperaturen, wenn man einem System, das eine Entropiekurve wie die gezeichnete hat, immer mehr Energie zufügt.
Tja, vom Standpunkt der theoretischen Thermodynamik aus gesehen ist das eigentlich schon alles, was es zur negativen Temperatur zu sagen gibt.
Schön wäre natürlich, man hätte eine Idee, was die Entropie genau ist und wie ein System aussehen muss, damit es eine Kurve wie die gezeichnete hat. Aber das verbanne ich in einen zweiten Teil…






Kommentare (31)