Bei der Untersuchung von Risikofaktoren für die Alzheimersche Krankheit kann David Snowdon von der Universität in Minnesota auf eine höchst bemerkenswerte Zielgruppe zugreifen: Seit 1986 findet in den USA eine Studie mit 678 katholischen Schwestern des Ordens Unserer Lieben Frau statt. Die Nonnen waren zu Studienbeginn mit 75 bis 102 Jahren alle schon im fortgeschrittenen Alter. Sie unterziehen sich zu Lebzeiten regelmäßigen Tests ihrer geistigen Leistungsfähigkeit und die Nonnen haben allesamt zugestimmt, dass ihr Körper nach dem Tod der medizinischen Forschung überlassen wird.
Vor allem eine detaillierte Untersuchung des Gehirns soll ergeben, in wie weit Alzheimer schon durch einfache Tests zu Lebzeiten vorausgesagt werden kann — und möglicherweise entsprechende Vorkehrungen getroffen werden können.
Die Nonnen eignen sich aus mehreren Gründen ganz ausgezeichnet als Studienobjekte. Seit Jahrzehnten wohnen sie zusammen, sie haben daher sehr ähnliche Tagesabläufe und soziale Bindungstrukturen. Weiter stellen sie durch ihre von weltlichen Versuchungen relativ freie Lebensweise eine recht homogene Gruppe dar: keine Drogen, kaum Alkohol, keine Kinder. Es gibt also wenige externe Faktoren, die bei der Auswertung der Korrelationen zwischen Zustand des Gehirns und dem Abschneiden bei den Tests berücksichtigt werden müssten.
Erste Ergebnisse der Nonnenstudie zeigen, dass Schwestern, die beim Eintritt in den Orden in ihrer Jugend schon komplexe und stilistisch flüssige Autobiografien verfassten, ein geringeres Risiko hatten später im Leben an Alzheimer zu erkranken — und da die meisten Nonnen sich weiterhin bester Gesundheit erfreuen, ist mit weiteren Ergebnissen auch erst in den nächsten Jahren zu rechnen.
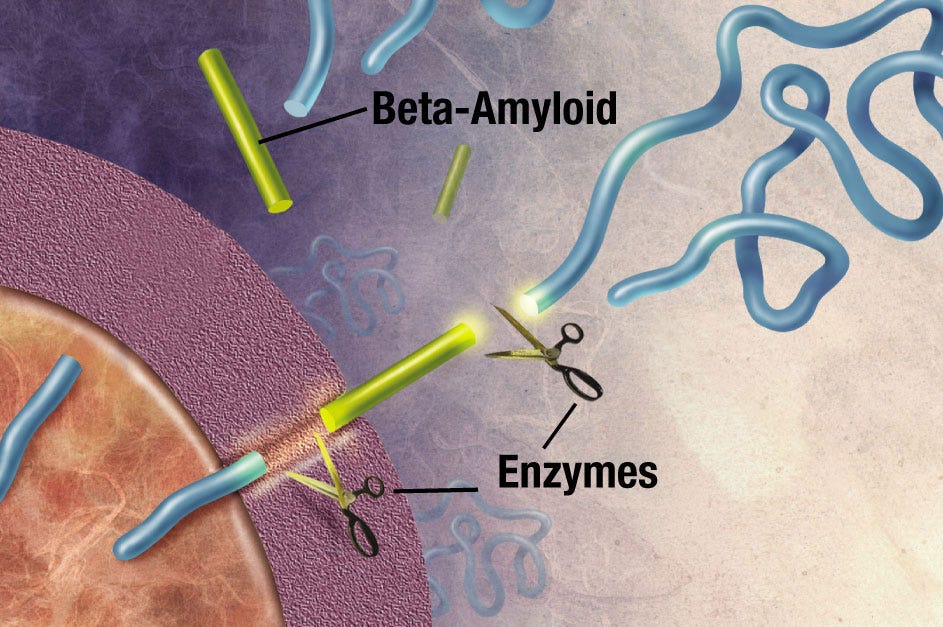
Die Untersuchungen der Gehirne der bislang verstorbenen Nonnen mit Alzheimer bestätigten die bislang bekannten Befunde: Neben einem deutlichen Zurückgang der Gehirnmasse, können in Dünnschnitten unter dem Mikroskop sogenannte Plaques identifiziert werden. Die Plaques bestehen hauptsächlich aus einem Teil des sogenannten Amyloiden Präproteins (APP) und die meisten Wissenschaftler sind sich einig, dass in diesem Protein der Schlüssel zum Verständnis der Ursachen und der molekularen Zusammenhänge der Alzheimerschen Krankheit auf zellulärer Ebene liegt
Die Molekularen Grundlagen von Alzheimer
Das Amyloide Präprotein kommt konzentriert in den Verbindungen von Nervenzellen zueinander vor, in den Synapsen im Gehirn. Die eigentliche Funktion von APP ist bislang nicht klar; man weiss jedoch, dass das Protein im Gehirn ständig neu gebildet und von sogenannten Sekretasen in Stücke geschnitten und wieder abgebaut wird. Eines der APP- Abbauprodukte, ein Proteinstück aus 42 Aminosäuren, genannt A-beta-42, hat eine physikalisch ungünstige Eigenschaft: Es kann mit seinesgleichen zusammenkleben, also aggregieren. Normalerweise werden auch die A- beta-42 Peptide, direkt nachdem sie entstehen, wieder entsorgt. Im Lauf eines Lebens kann es aber zu deren Anhäufung kommen — mit fatalen Folgen:
Die Reizübertragung zwischen Nervenzellen wird behindert; Im Gehirn laufen Entzündungsprozesse ab und größere Mengen aggregierter A- beta-42 Peptide bilden eben die für Alzheimer typischen und unter dem Mikroskop identifizierbaren Plaques, in die auch andere, wichtige Proteine rekrutiert werden können. Innerhalb von Nervenzellen bilden sich fibrilläre Knäule aus dem sogenannten Tau-Protein, was schließlich dazu führt, dass die betroffenen Zellen absterben. Dieser Nervenzellverlust ist der Grund für den nach dem Tod messbaren Zurückgang der Gehirnmasse bei an Alzheimer erkrankten Menschen.
. 
Diese komplexen und nur bislang unvollständig verstandenen Vorgänge im Gehirn gehen im Verlauf der Alzheimerschen Krankheit mit dramatischen Symptomen und Folgen für Betroffene und deren Angehörige einher. Anfängliche Wortfindungsstörungen und lückenhafte Erinnerungen führen über Jahre zum kompletten Verlust kognitiver Fähigkeiten bis hin zum Vergessen des eigenen Namens und zur Unfähigkeit, sich verbal zu äußern. Damit einher gehen deutliche Veränderungen des Charakters, Misstrauen den Nächsten gegenüber, ungekannte Aggressivität und Feindseligkeit gegenüber bislang Vertrauten, bis zu vollständiger Demenz.
Es wird angenommen, dass derzeit rund 700 000 Menschen in Deutschland an Alzheimer erkrankt sind. Die Zahl wird in Folge der Erhöhung der durchschnittlichen Lebenserwartung weiter steigen, da bei alten Menschen das Erkrankungsrisiko ungleich höher ist: Während 3% der 65-69-Jährigen Alzheimer Symptome zeigen und 9% bei den 75-79-Jährigen, sind es bei den 85-89-Jährigen bereits rund 40%. Wir werden zwar immer älter aber leider auch immer häufiger dement.
Die Suche nach den Risikofaktoren erlaubt möglicherweise präventiv der Krankheit zu begegnen oder zumindest deren Fortschreiten zu verzögern. So kann die langfristige Einnahme von bestimmten entzündungshemmenden Medikamenten die Gefahr an Alzheimer zu erkranken verringern.
Die Erforschung der molekularen Ursachen und Zusammenhänge der Alzheimerschen Krankheit eröffnet außerdem therapeutische Ansätze für diese häufigste Demenzkrankheit. Die Symptome können beispielsweise durch die medikamentöse Beeinflussung der Reizübertragung zwischen Nervenzellen abgemildert werden. Es ist weiter denkbar, direkt auf die Bildung oder die Aggregation des A-beta-42 Peptides Einfluss zu nehmen. Möglicherweise haben Derivate des Tetrahydrocannabinol (THC), der aktiven Substanz in Marihuana, ebenfalls einen positiven Effekt auf den Verlauf der Krankheit und können gar therapeutisch eingesetzt werden.
Was haben Alzheimer und BSE gemeinsam?
Das Amyloide Präprotein APP, bei dessen Prozessierung das Plaque-bildende A-beta-42 Peptid entsteht, ist nicht das einzige Protein, das direkt Krankheiten auslösen kann. Vor achtzehn Jahren kam es zu einer wahren Massenpanik, als bekannt wurde, dass einige Briten nach dem Verzehr von Gerichten, die vornehmlich Rinderhirn enthielten, an einer seltsamen neurodegenerativen und tödlich verlaufenden Krankheit litten, der bovinen spongiformen Enzephalopathie, kurz BSE.
Bilder von Rindern, die an BSE litten und auf den Knien rutschend durch den Matsch auf britischen Bauernhöfen zur Schlachtbank getrieben wurden, waren Teil der Abendnachrichten. Es kam schon bei einzelnen Verdachtsfällen zu Massentötungen von ganzen Rinderherden und von der EU wurde ein Exportverbot für britisches Fleisch ausgesprochen. Noch nie zuvor konnte man beim Metzger so gutes Rindfleisch so günstig einkaufen; genießen konnten es allerdings nur die Mutigen.
Die verantwortlichen Erreger waren weder Parasiten, Bakterien oder Viren, sondern Proteine, sogenannte Prionen. Prionproteine können spontan ihre Stuktur ändern und in einer Kettenreaktion gleiche Proteine mit der ursprünglichen Struktur ebenfalls dazu bewegen, die veränderte, krank machende Form anzunehmen. Das ist, vereinfacht gesagt, die Prionenhypothese, für deren Postulierung und für die Entdeckung, dass die infiziösen Partikel tatsächlich Proteine sind, Stanley Prusiner 1998 den Nobelpreis für Medizin bekam.
Die veränderte Variante des Prionproteins führt nicht direkt zu den typischen motorischen Ausfallserscheingungen, es sind — ähnlich wie bei Alzheimer — nachgeordnete Effekte in den betroffenen Zellen, die für das Krankheitsbild verantwortlich sind. Veränderte Prionproteine aggregieren und rekrutieren andere wichtige Proteine der Zelle. Diese Aggregate können von der Zelle nicht mehr entfernt werden, sie häufen sich an und bringen das empfindliche Gleichgewicht aus Proteinsynthese und -abbau durcheinander.
Höchstwahrscheinlich weiß sich die Zelle dann nicht mehr anders zu helfen, als den eigenen Tod einzuleiten. Da das Prion-Protein hauptsächlich in Nervenzellen und im Gehirn vorkommt sind es eben jene Zellen die in Folge der Erkrankung absterben und zu den beobachteten Symptomen bis hin zum Tod führen. Wenn die Gehirne von betroffenen Menschen oder Tieren nach deren Ableben untersucht werden, ist das Organ durch den massenhaften Zelltod regelrecht durchlöchert und sieht aus wie ein Schwamm. Daher wird diese Erkrankung in der Fachsprache auch spongiforme Enzephalopathie, also schwammförmige Gehirnkrankheit genannt.
Der Grund für die Verbreitung von BSE bei den britischen Rindern war damals das Zufüttern von unzureichend aufbereitetem Tiermehl von Schafen, die an Scrapie, einer ähnlichen Krankheit litten. Schafe mit Scrapie, Rinder mit BSE und Menschen mit einer Variante der Creutzfeld-Jakob-Krankheit. Drei Namen in drei Spezies für letztendlich die gleiche neurodegenerative Krankheit.
Bereits Ende der 1950er Jahre wurde in Papua-Neuguinea eine ganz ähnlich verlaufende Krankheit entdeckt. Sie wurde unter dem Namen bekannt, den ihr die betroffenen Angehörigen des dort ansässigen Stammes der Fore gaben: Kuru. Der Arzt Daniel Carleton Gajdusek lebte mit den Fore, beschäftigte sich mit deren Kultur, und obduzierte Leichen, die an Kuru verstorben waren. Er vermutete, dass sich die Stammesangehörigen bei ihren Ahnen ansteckten, da ein kannibalistisches Bestattungsritual darin bestand, das Hirn der verstorbenen Verwandten zu verspeisen. Gajdusek bewies die Übertragbarkeit der Krankheit in Experimenten mit Affen.
Er bekam für seine Arbeit 1976 den Nobelpreis für Medizin, und obwohl er selbst in seiner Rede in Stockholm den Erreger noch ein “ungewöhnliches Virus” nannte, wurden bereits damals Parallelen zu Scrapie bei Schafen gezogen und es war bekannt, wie die Erreger der seltsamen Krankheit unschädlich gemacht werden konnten, zum Beispiel durch Autoklavieren, also durch eine halbstündige Garzeit bei 121°C im Dampfkochtopf. Hätten sich die Briten die Nobelpreisrede von Gajdusek gründlich durchgelesen, bevor Sie das unzureichend aufbereitete Tiermehl an ihre Rinder verfüttert hätten, wären wohl rund 200 Menschen weniger gestorben — und über vier Millionen Rindern wären, statt auf dem Scheiterhaufen und im Krematorium, auf den Tellern gelandet.


Kommentare (25)