Wenn man das Leben verstehen will, muss man dabei zuschauen wie es Dinge tut. In eine lebende Zelle zu schauen funktioniert nicht ohne Markierung mit Farbstoffen – die einzelnen Teile die mitspielen sind kleiner als das sichtbare Licht, weswegen man sie nicht direkt sehen kann. Es gibt viele Möglichkeiten Farbstoffe in eine lebende Zelle zu bringen. Die schonenste Methode ist „Nanoinjection“, eine Technik die recht neu ist und bisher wenig beachtet wurde.
Das Problem
Zellen sind klein. Eine typische menschliche Hautzelle misst bis zu 0,05 mm in der längsten Richtung und 0,01 mm in der kürzesten. Man hat wenig Probleme sie unter einem Mikroskop zu betrachten, wenn man ein paar kleine Tricks anwendet.
Will man aber in eine Zelle hinein schauen, um etwas darüber zu lernen wie diese kleine Einheit des Lebens funktioniert und Dinge tut, dann muss man anfangen die Strukturen anzufärben, wie ich das im Artikel Das bringt Farbe ins Leben bereits erklärt habe. Damit man schöne Bilder machen kann, muss die Zelle still halten, angefärbte Zellen, besonders bei mehreren Farben, sind meistens fixierte Zellen – also längst tot. Wenn man in eine lebende Zelle schauen will, muss man sich Wege überlegen die fluoreszenten Farbstoffe in die Zelle zu bringen, ohne die Zelle so stark zu verletzen, dass sie anschließend nicht mehr weiter leben kann. Besser noch: Man bringt die Farbstoffe so in die Zelle, dass sie eigentlich kaum gestört wird und davon nichts merkt – damit sie weiter das tut was eine Zelle eben tut, so als ob nichts gewesen wäre. Denn genau das will man ja beobachten.
Die Sache mit dem Markieren
Um die ganze Geschichte mit dem “Zelle verletzen” zu umgehen, kann man die Genetik benutzen. Wenn man die DNA von Zellen so manipuliert, dass eine bestimmte Eiweißsorte in der Zelle so zusammen gebaut werden das sie das grün fluoreszierende Protein (GFP) tragen, dann leuchten diese Strukturen von sich aus. Der Pferdefuß an dieser Herangehensweise ist, dass man die innere Struktur der Zelle verändert, und wenn an irgend einem Eiweiß noch ein leuchtender Blob dran hängt, kann man nicht sicher sagen, dass die Zelle ganz genau so funktioniert wie ohne den leuchtenden Blob.
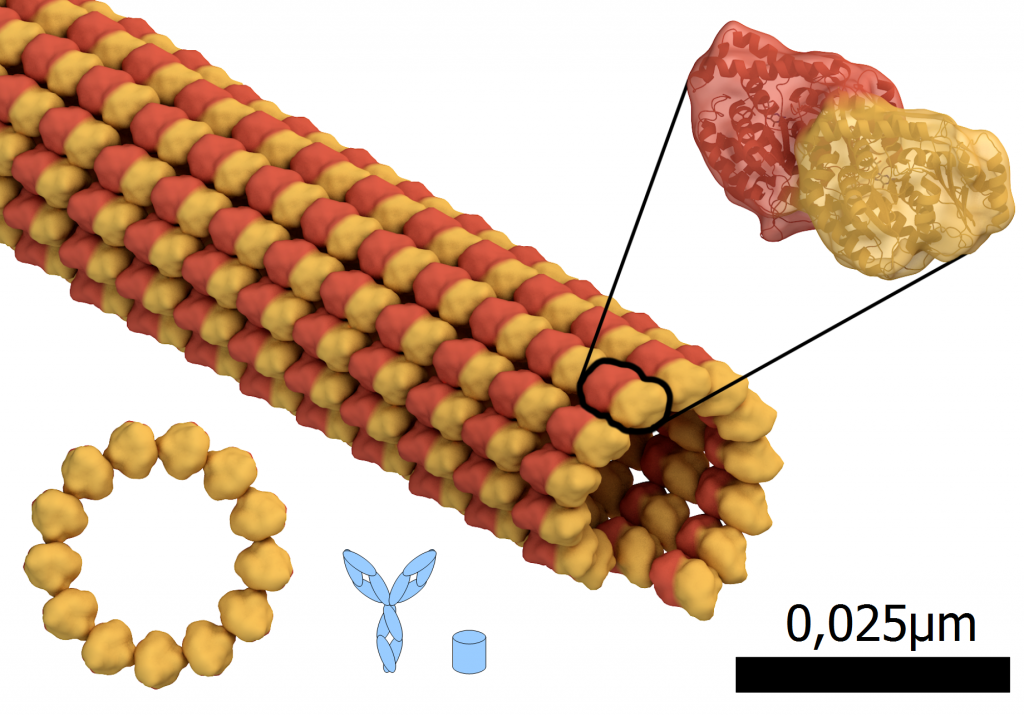
Größenvergleich: Microtubul, Teil des Zellskeletts, rot: alpha-tubulin Eiweiß, gelb: beta-tubulin Eiweiß, blau: Antikörper und GFP. Durchmesser des Microtubuls: 0,024µm oder 24nm. Basierend auf “Microtubule structure.png” von Thomas Splettstoesser (www.scistyle.com); CC-BY-SA 4.0 André Lampe
Im Bild oben sieht man, dass ein GFP kleiner ist als ein Tubulin-Eiweiß, die Proteine, die ein Microtubulu bilden. Stellt man sich aber vor, dass an JEDEM Tubulin-Protein so eine kleine Tonne dran klebt, weiß man ungefähr was ich meine mit “so funktionieren wie vorher”. Wählt man genetische Methoden kann man leider nicht steuern, dass nur jedes fünfzigste Protein ein GFP drangebastelt bekommt – Genetik funktioniert in diesem Fall nach dem Alles-oder-Nichts-Prinzip.
Man kann auch fluoreszierende Farbstoffe in die Zelle bringen, die deutlich kleiner sind als das GFP. Die müssen allerdings an etwas gebunden sein, dass dafür sorgt, dass sie auch an der richten Stelle binden und nicht irgendwas markieren. In fixierten (also toten Zellen) benutzt man meistens Antikörper. Denen kann man beibringen an alles möglich zu binden, und selbst wenn diese Bindung nicht sehr stark ist, wird das Bild nachher ganz schön, denn in fixierten Zellen kann man „waschen“, das heißt Antikörper die irgendwo liegen geblieben sind entfernen, dass am Ende wirklich nur die Struktur markiert ist für die man sich interessiert.
In lebenden Zellen funktioniert das waschen leider nicht. Um an herumliegende Antikörper ran zu kommen müsste man das innere der Zelle einmal durchspülen – Vergleichen könnte man das mit dem Versuch ein Hühnerei auszublasen, die Schale einmal mit Seife auszuwaschen, das glibbrige Zeug wieder reinzupuzzeln und am Ende zu hoffen das man es noch zu einem Küken ausbrüten kann. Waschen geht also nicht, was den Einsatz von Antikörpern ziemlich schwierig macht. Deswegen werden Farbstoffe oft an Chemikalien gekoppelt die sich sehr zielsicher in eine alpha-Helix der DNA legen (Interkalatoren) oder aus bestimmten Teilen von Giften bestehen die zielgenau an das Aktin binden, ein wichtiger Teil des Zellskeletts (z.B. Phalloidin oder Paclitaxel)*. Egal wie man den Farbstoff mit etwas ausstattet, dass etwas spezifisch markieren kann – man kann über diese Strategie die Menge an Markern sehr gut steuern, im Gegensatz zu der genetischen Variante mit GFP. Oft reicht es für die Mikroskopie auch vollkommen wenn nur jedes hundertste Protein markiert ist um die Struktur gut zu erkennen, wenn man sich im Bild oben mal anschaut wie dicht die Bausteine dort gepackt sind.
Um etwas in lebende Zellen hinein zu bekommen gibt es auch mehrere Ansätze. Man kann Elektroporation benutzen. Dabei werden durch ein elektrisches Feld Löcher in die Zellwand gerissen, durch die Marker hinein kommen können. Klingt nicht gerade schonend und ist es auch nicht. Auch ist diese Methode nicht geeignet einzelne Zellen zu markieren. Es werden immer sehr viele Zellen auf einmal „behandelt“. Neben anderen, ebenfalls recht harschen Herangehensweisen gibt es auch noch die Microinjection. Eine Nadel (Mikropipette) mit einem Durchmesser zwischen 0,5µm bis 5µm wird in die Zellwand gestochen und Fremdmoleküle werden über Druck injiziert. Die Methode erlaubt es einzelne Zellen gezielt zu manipulieren. Dabei wird die Zelle kurzzeitig wie ein Ballon aufgebläht, kehrt aber nach kurzer Zeit in den Ausganszustand zurück, schließlich hat man mit der nicht gerade kleinen Nadel ein Loch in die Zellwand gestochen. Ein Durchmesser von 0,5µm ist für eine solche Nadel die absolute Untergrenze, filigranere Nadeln würden durch den Druck der Injektion bersten.
Die meisten Zellen (ca. 50-60%) kommen damit nicht gut klar und sterben bei oder kurz nach der Injektion.
Also ist Nanoinjection doof? Moment… Micro? Nano?
Microinjection ist schon eine ziemlich Holzhammermethode. Und warum soll dann Nanoinjection schonend und besser sein, wie ich ganz oben angedeutet habe? Die Techniken unterscheiden sich doch nur durch eine Vorsilbe! Mikro – Nano – was ist das schon für ein Unterschied? Beides ziemlich klein, oder?
Verdammt klein, besonders wenn man bedenkt, dass ein menschliches Haar einen Durchmesser von 100µm haben kann, heißt das, dass die Spitze einer Mikropipette 20-200 Mal kleiner ist als der Durchmesser eines Haares. Nanoinjection treibt die Sache jetzt aber ein Stückchen weiter als man denken würde. Bei dieser Technik ist die Spitze der Nadel (Nanopipette) kleiner als 0,1µm (oder 100nm), also 1000 Mal kleiner als ein Haar. Damit ist die Untergrenze aber noch nicht erreicht. Nanopipetten können bis 10 nm im Durchmesser klein sein. Wenn man die „Fläche“ der Spitze einer Nanopipette betrachtet, im Vergleich zur kleinsten Mikropipette, heißt das eine knapp 33-fach kleinere Einstichfläche (pi * 50nm² vs pi * 250nm²). Die Nanopipette ist also so klein, dass man sie nicht einmal mehr unter dem Mikroskop sieht. 100nm, das ist unter der Beugunsgrenze des sichtbaren Lichts die von Abbe und Rayleigh beschrieben wurde.
Man kann jetzt natürlich einwenden: „Moment mal, war da eben nicht die Rede davon, dass so kleine Nadeln Injektionsdrücke nicht aushalten?“, und man hätte recht damit. Der Clou bei der Nanoinjection ist, dass nichts injiziert wird, jedenfalls nicht über Druck und einer damit verbundenen Volumenänderung innerhalb der Zelle. Die „Injektion“ basiert allein auf der Bewegung von geladenen Molekülen innerhalb eines elektrischen Feldes. Das hat den Vorteil, dass nur die Moleküle injiziert werden, die auch wirklich in die Zelle sollen. Man kann sich das ungefähr so vorstellen, dass die Moleküle durch die Nanopipette zur Spitze hin wandern und dann in die Zelle weitergehen. Im Gegensatz zur Microinjection, bei dem die Injektion in einem Puls abläuft ist es also ein kontinuierlicher Prozess. Das hat den Vorteil, dass man nicht vorher bestimmen muss wie viel man injiziert, sondern man stoppt den Injektionsvorgang einfach, wenn die Zelle genügend Moleküle aufgenommen hat. Man kann den Prozess bei fluoreszierenden Molekülen sogar unter dem Mikroskop beobachten.
Wie sticht man etwas mit einer Nadel, die man nicht sehen kann?
Mit Gefühl. Obwohl ein Mikroskop ein optisches Instrument ist, muss man sich ja nicht zwangsläufig auf das Visuelle verlassen. Wie oben schon erklärt, werden die Farbstoffe aus der Nanopipette mit Hilfe eines Ionenflusses abgesetzt, also durch das Anlegen eines elektrischen Feldes. Dieses Feld muss sehr genau angesteuert werden können und genau kontrolliert und gemessen werden – schließlich sprechen wir hier von wenigen Molekülen. Und genau diesen Ionenfluss kann man auch für die Abstandsmessung ausnutzen. Wenn man die Nanopipette direkt von oben nach unten in Richtung der Zelle steuert kann man eine Abnahme des Ionenflusses messen, je näher man der Zelloberfläche kommt. Diese Technik nennt man SICM, was kurz für scanning ion-conductance microscope ist. Damit kann man die Zelloberfläche sehr genau kartieren und ist ein weiterer Vorteil der Nanoinjection-Methode. Nicht nur weil man quasi einen weiteren Sinn, also eine zusätzliche Messgröße hat, sondern auch weil es eine Möglichkeit zur Automatisierung bietet. Würde man die Position optisch kontrollieren (wenn man die Nadel sehen könnte), müsste man relativ komplexe Software zur Bilderkennung einsetzen, bei der der Teufel im Detail liegt. Wenn man aber den Abstand als Funktion eines Stromes messen kann, hat man eine recht zuverlässige Messgröße um einfache Aufgaben zu automatisieren. Zum Beispiel: “Stich mir mal diese zwanzig Zellen an, die ich markiert habe und setze jeweils 200 Farbstoffe ab.”
Die Summe von vielen, kleinen Ideen
Es gibt also einige Grundlegende Unterschiede und vor allem Vorteile zur Microinjection. Deutlich kleinere Nadel durch die die Zelle weniger beschädigt wird. Keine Belastung der Zelle durch zusätzliches Volumen beim Absetzen von Farbstoffen durch ein elektrisches Feld. Zuschauen, wie die Moleküle in die Zelle gelangen mit Fluoreszenzmikroskopie und damit die Kontrolle über die abgelegten Moleküle. Präzise Annäherung und Positionsbestimmung der Nanopipette, Automatisierbar durch die Abstandsmessung mit Hilfe von Ionenströmen (SICM). Das sind viele Fakten, die mir am Anfang den Blick auf das Potential dieser Technik genommen haben und ich dachte erstmal “so what?”
Das was mir dann irgendwann mal hat ein Lichtlein aufgehen lassen war das Stichwort Automatisierbarkeit. Man könnte mit der Nanoinjection automatisch zwanzig Zellen ansteuern und ein bestimmtes Programm fahren und mit zwanzig anderen Zellen ein anderes, alles auf demselben Objektträger, in derselben Probe. In der Biologischen Forschung muss man für alle Experimente Kontrollen machen, das heißt unbehandelte Zellen derselben Zelllinie und derselben Charge zu jedem Experiment “mitziehen” um eine Probe des “normalen” oder “natürlichen” zu haben, eben etwas mit dem man das Experiment vergleichen kann. Mit der Nanoinjection könnte man die Kontrolle auf in ein und derselben Probe erledigen. Das mag nicht nach viel klingen, aber wenn ihr eine/n Biolog*in fragt – leuchtende Augen.
Aber das ist nicht der einzige potentielle Vorteil. Die meisten Forschungsergebnisse der Biologie oder Medizin, die mit einzelnen Zellen zu tun haben, bilden einen Mittelwert über sehr sehr viele gemessene Zellen um eine Aussage treffen zu können. Statistisch nennt man das auch Ensemble. Mit der Nanoinjection wäre es möglich, dass man vom Ensemble weg kommt und Zellen wirklich einzeln untersucht. Durch die Automatisierbarkeit der Technik und dadurch, dass die Zelle kaum etwas von der Nanoinjection merkt, wird das überhaupt erst möglich. So könnte man Effekte entdecken die in der Individualität der einzelnen Zelle begründet sind. Im Ensemble (bei dem man eben über viele Zellen mittelt) würde man diesen Effekt nicht erkennen. Mit Nanoinjection würde man diese Art von Effekt leicht detektieren können.
Es ist immer schwer vorher zu sagen welche Ergebnisse eine neue Herangehensweise in der Forschung bringen wird, ganz besonders in der biologischen und medizinischen Forschung. Auf jeden Fall spielt in der Welt des ganz kleinen die Größe immer noch eine wesentliche Rolle und ich persönlich finde die Idee Dinge mit einer Nadel zu machen, die man unter dem Mikroskop nicht sehen kann verdammt cool. Das Paper gibt es hier… leider nur closed access. Aber man kann ja den Autor anschreiben, wenn man das Paper unbedingt selbst lesen will – oder andere Tricks und Tools einsetzen die draußen im Netz so herumgeistern. Man sollte auf keinen Fall sci-hub benutzen, so wie es im Moment aussieht ist der dort angebotene Service etwas verbotenes.
Fußnoten:
* Es gibt auch noch FLAG oder HALO Tags, die genau wie GFP, mit genetischen Methoden an Proteine gebastelt werden können. Die sind teilw. kleiner als GFP, aber das Problem “funktioniert das genauso wie ohne” bleibt.

 orcid.org/0000-0003-0750-4757
orcid.org/0000-0003-0750-4757
Kommentare (3)