Ich habe kürzlich über Öffentlichkeitsarbeit in der Chemie geschrieben und mir wieder einmal mehr populärwissenschaftliche Informationen aus der Chemie gewünscht. Und Hurra! Ole hat sich gemeldet und nicht nur damit begonnen, ein Blog über Chemie zu schreiben sondern auch gleich einen Gastbeitrag verfasst, den ich euch hier sehr gerne vorstellen. Ole freut sich sicher über Feedback (aber berücksichtigt dabei, dass jedes Blog seine eigene Zielgruppe hat und die Leserschaft von “Astrodicticum Simplex” nicht unbedingt die Leserschaft sein muss, die Zielgruppe von Oles Chemie-Blog ist) – und schaut auf jeden Fall in seinem Blog vorbei. Besonders der Artikel über eine neu entdeckte Struktur von Eis ist enorm faszinierend!
————————————————————————–
Möchte man ein Molekül im Labor synthetisieren, werden meist zwei kleinere Moleküle über eine kovalente Bindung verbunden. Diese Reaktionen können je nach gewünschten Zielprodukt beliebig kompliziert werden und oftmals gibt es keinen allgemeingültigen Weg um aus A und B, C zu erhalten. Denn auch wenn der Reaktionsmechanismus identisch ist, kommt es spätestens bei der Abtrennung des gewünschten Produktes aus der Reaktionsmischung (allgemein wird dies als Aufreinigung bezeichnet) zu spezifischen Problemen (Polarität, stereochemische Auftrennung, …).
Ihr braucht also keine große Vorstellungskraft um zu erkennen, dass solche Synthesen (und Aufreinigungen) einiges an Zeit und Nerven kosten können. Wie schön wäre es, wenn man einfach Lego mit den Molekülen spielen könnte und auch die Aufreinigung der Produkte unabhängig von dem spezifischen Produkt geschehen könnte.
Für Peptide und Oligonucleotide konnte schon eine solche automatisierte Lego/Baukasten Methode entwickelt werden (1).
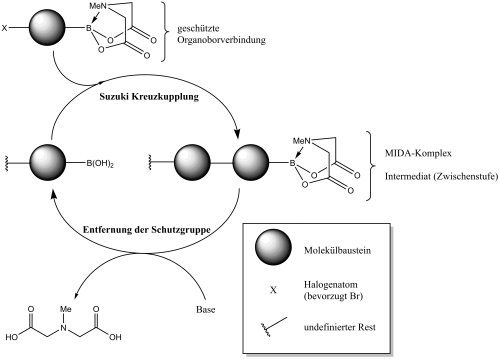
Ein ähnliches System ist nun aber auch für kleine organische Moleküle von Marty Burke aus Illinois vorgestellt worden (2). Die Gruppe und Burke nutzt als Kupplungsreaktion der verschiedenen Bausteine die Suzuki-Kupplung aus. Dabei werden Organoborverbindungen – dabei handelt es sich um organische Verbindungen, die eine Kohlenstoff-Bor Bindung aufweisen – mit Halogenarylen und -vinylen mittels Palladiumkatalysatoren gekoppelt. Damit die ganze Reaktion iterativ stattfinden kann müssen die eingesetzten Bausteine sowohl Organoborverbindungen als auch Halogenaryl bzw. -vinyle sein. Um ungewollte Reaktionen auszuschließen muss vor jedem Kupplungsvorgang an dem neuen Baustein das Bor-Atom geschützt werden, d.h. es findet eine selektive Reaktion an dem Bor statt, wodurch dieses in der eigentlichen Kupplungsreaktion nicht mehr aktiv ist. Nach der Kupplungsreaktion muss dann in einem weiteren Schritt mit einer Base die so genannte Schutzgruppe wieder entfernt werden, damit das neue Molekül in einer weiteren Kupplungsreaktion eingesetzt werden kann. Die Gruppe um Burke hat dies mit MIDA-Boronaten umgesetzt. MIDA-Boronate wurden genutzt weil sie vergleichsweise stabil sind und kommerziell in großer Vielfalt verfügbar sind.
Nachdem nun das grundsätzliche Prinzip erläutert ist fehlt noch der entscheidende Aufreinigungsschritt. In der organischen Synthese wird dies meist mittels Chromatographie realisiert, was äußerst aufwendig und für jedes Molekül sehr spezifisch ist. Die Gruppe um Burke hat aber festgestellt, dass der MIDA-Komplex – das Intermediat nach jeder Kupplung – bei Verwendung von Methanol und Diethylether an Silica adsorbiert, mit Tetrahydrofuran aber wieder vom Silica gelöst werden kann. Dieses Verhalten eignet sich um eine Reinigung durchzuführen, dazu wird einfach nach der Kupplung das Reaktionsgemisch in Methanol und Diethylether gelöst, auf Silica gegeben und mehrmals mit Methanol und Diethylether gewaschen. Um es in den nächsten “Prozessschritt” zu überführen wird zum Schluss einfach das Lösungsmittel zu THF gewechselt und der MIDA-Komplex befindet sich wieder in der Lösung.
In dem Paper werden einige verschiedene Produkte gezeigt die mit dem oben beschriebenen Verfahren in einem selbstgebauten Automaten synthetisiert wurden. Es sollte aber noch erwähnt werden, dass die Ausbeuten noch sehr niedrig sind. Auch wird es wohl kaum den organischen Chemiker im Labor ablösen, da mit diesem Verfahren nur Kupplungsreaktionen durchgeführt werden. Auch industriell wird dieses Verfahren wohl eher keine Anwendung finden, da man dort in einer Anlage meist nur ein bestimmtes Produkt herstellt und dieses in größt möglicher Ausbeute mit möglichst wenig Prozessschritten realisiert. Der Ansatz von Burke ist eher mit einer Brechstange zu vergleichen. Er hat gezeigt, dass viele Moleküle über seine Methode mit minimalen Aufwand zugänglich sind. Es sollte aber unbedingt weiterbeobachtet werden, wass daraus entstehen kann.
Schöne Überblicke über die Bewertung des Papers wurden in der englischsprachigen Community veröffentlicht. Schaut dazu mal hier vorbei:
https://pipeline.corante.com/archives/2015/03/13/objections_to_the_end_of_synthesis.php
https://wavefunction.fieldofscience.com/2015/03/molecules-software-and-function-why.html
Literatur:
(1) Merrifield, R. B. „Solid Phase Peptide Synthesis. I. The Synthesis of a Tetrapeptide“. Journal of the American Chemical Society 85, Nr. 14 (1. Juli 1963): 2149–54. doi:10.1021/ja00897a025.
(2) Li, Junqi, Steven G. Ballmer, Eric P. Gillis, Seiko Fujii, Michael J. Schmidt, Andrea ME Palazzolo, Jonathan W. Lehmann, Greg F. Morehouse, und Martin D. Burke. „Synthesis of many different types of organic small molecules using one automated process“. Science 347, Nr. 6227 (2015): 1221–26.











Kommentare (3)