Hinweis: Dieser Artikel ist ein Beitrag zum ScienceBlogs Blog-Schreibwettbewerb 2016. Hinweise zum Ablauf des Bewerbs und wie ihr dabei Abstimmen könnt findet ihr hier.

Das sagt der Autor des Artikels, Isaak Unger über sich:
Isaak Unger hat in Berlin Physik studiert und hat anschließend am Helmholtz-Zentrum Berlin / der FU Berlin promoviert (und wartet im Moment auf die Promotionsurkunde). Zur Zeit arbeitet er an der Universität Uppsala in Schweden. Er versucht sich hier im Schreiben eines Blogs mit der Hoffnung der Allgemeinheit etwas für die in seine Forschung investierten Gelder zurückzugeben und die eine oder den anderen für die Komplexität kleiner Moleküle in Lösung zu begeistern.
——————————————
Der Titel klingt nach Esoterik und Homöopathie? Einhörnern und Yetis? Da ist was dran, aber dass dies nur eine Frage der überspitzten Formulierung ist, hoffe ich euch im Folgenden näher bringen zu können. Überhaupt hoffe ich euch für Wasser auch auf der molekularen Ebene ein wenig interessieren zu können. Ob mir das gelingt? – Mal sehen. Wahrscheinlich macht man sich im Alltag nicht so häufig Gedanken über Wasser: Wasserhahn aufdrehen – da ist es! Wann wird man auch bewusst mit dem Thema Wasser konfrontiert? Beim Wassersparen, Wassermangel, saurem Regen und wenn man den Regenschirm zu Hause vergessen hat. Das sind aber alles Themen, die sich um den Wasserhaushalt drehen und man sollte annehmen, dass so ein kleines, allgemein bekanntes und allgegenwärtiges Molekül keine großen Überraschungen mehr bergen sollte. Wasser ist regelrecht langweilig. Dachte ich. Dann begann ich mich aus der Perspektive eines Festkörperphysikers dem Thema zu nähern und natürlich war auf einmal garnichts mehr einfach. Mehr noch: Ich musste feststellen, dass unser altes, allgegenwärtiges und langweiliges Wasser auf vielen Ebenen seher schlecht verstanden ist und viele Anomalien birgt. Die wohl bekannteste ist, dass es sich beim frieren ausdehnt, anstatt sein Volumen weiter zu verringern. Die meisten werden sich noch daran erinnern, dass man geschlossene und gefüllte Wasserflaschen besser nicht zu lange im Gefrierschrank lässt.
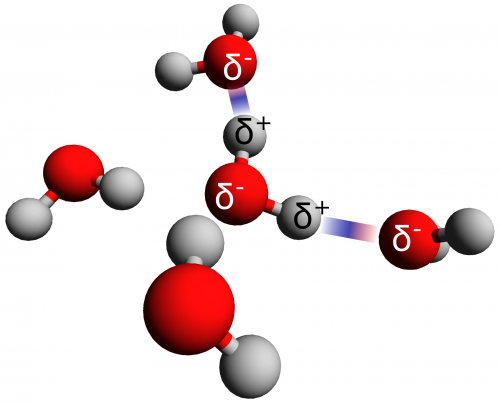
Die Volumenvergrößerung beim Frieren ist aber nur eine der vielen Anomalien dieses kleinen Moleküls und bis dato ist noch kein umfassendes Modell entwickelt worden, das all diese Anomalien befriedigend erklärt. Allein schon die Anordnung der Moleküle in normalem, flüssigem Wasser ist unter einigen Wissenschaftlern umstritten. Das vorherrschende Modell geht davon aus, dass jedes Wassermolekül von vier anderen Wassermolekülen umgeben ist, die an den Ecken eines Tetraeders angeordnet sind. Zu jedem Nachbarmolekül wird eine Wasserstoffbrückenbindung aufgebaut (wie ich im Bild versucht habe zu skizzieren). (Wasserstoffbrückenbingung? Was war das nochmal? In der Box habe ich es versucht zu umreißen.
Wasserstoffbrückenbindungen sind Bindungen zwischen Molekülen, die an verschiedenen Stellen unterschiedlich partiell geladen sind (symbolisiert mit δ+ bzw. δ–). Im Beispiel ‘Wasser’ führt der unterschiedliche Elektronegativitätswert der Sauerstoff- und Wasserstoffatome zur Ausbildung der Partialladungen. Der Elektronegativitätswert gibt dabei, vereinfacht, die Fähigkeit eines Atoms an in einer chemischen Bindung die Elektronen ‘an sich zu ziehen’. Der Elektronegativitätswert von Sauerstoff ist höher, als der von Wasserstoff, so dass das Sauerstoffatom die Elektronen ‘an sich zieht’ und dadurch partiell negativ geladen wird; die Wasserstoffatome werden entsprechend partiell positiv geladen. Kommen sich zwei Wassermoleküle nahe, so richten sie sich entsprechend dieser intramolekularen Partialladungen zueinander aus. Das läuft darauf hinaus, dass ein Wasserstoffatom eines Moleküls zum Sauerstoffatom des Nachbarmoleküls zeigt. Die daraus resultierende Anziehung zwischen dem ‘positiv geladenen Ende’ des einen Wassermoleküls und dem ‘negativ geladenen Ende’ des Nachbarmoleküls ist die Wasserstoffbrückenbindung.
Häufig wird davon gesprochen, dass viele Wassermoleküle ein Wasserstoffbrücken-Netzwerk aufbauen. Im Wesentlichen entspricht diese Struktur der von Eis. Das mag sich jetzt etwas verwunderlich anhören, schließlich entsprechen Eis und flüssiges Wasser zwei verschiedenen Aggregatzuständen. Der Unterschied zwischen flüssigem Wasser und Eis liegt in der Dynamik des Wasserstoffbrücken-Netzwerks. In flüssigem Wasser brechen die Wasserstoffbrückenbindungen sehr häufig auf, ein Wassermolekül rotiert und sucht sich einen anderen Bindungspartner für die Ausprägung einer neuen Wasserstoffbrückenbindung. Dieser Prozess dauert ca. 2,3 Picosekunden (billionstel Sekunden) und beeinflusst weitere Wassermoleküle in der näheren Umgebung, die ebenfalls Bindungen auflösen, rotieren und neue Wasserstoffbrückenbindungen aufbauen (schließlich hätten wir sonst ein Wassermolekül mit fünf und eins mit nur drei Bindungspartnern). In dieser stetigen Fluktuation des Wasserstoffbücken-Netzwerks liegt begründet, weshalb Wasser fließt und Eis dies bestenfalls sehr langsam tut (denkt man z.B. an Gletscher).
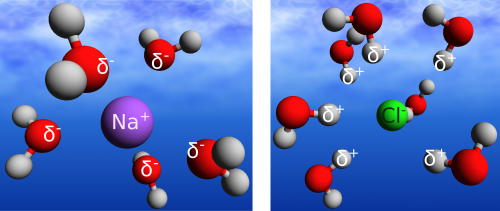
Die Dynamik des Wasserstoffbrücken-Netzwerks kann durch Fremdkörper im Wasser beeinflusst werden. Fremdkörper, das können schon einfache Ionen sein, wie zum Beispiel Natrium- und Chlorid-Ionen nach dem Auflösen von Kochsalz. In dieser Salzlösung befinden sich dann negativ geladene Chlorid-Ionen (Cl–(aq)) und positiv geladene Natrium-Ionen (Na+(aq)). Das ‘(aq)’ gibt dabei an, dass es sich um Ionen in wässriger Lösung handelt, die Ionen also von Wassermolekülen umgeben sind. Um Natrium-Ionen und Chlorid-Ionen ordnen sich je 5 bzw. 7 Wassermoleküle an, wie im Bild dargestellt – diese Wassermoleküle bilden die sogenannte erste Solvatschale um das Ion. Je nach Größe des Fremdmoleküls im Wasser kann die erste Solvatschale mehr oder weniger Wassermoleküle umfassen – so beinhaltet die erste Solvatschale von großen Biomolekülen wie Proteinen, die selbst hunderte von Atomen beinhalten können auch entsprechend mehr Wassermoleküle.
Aber zurück zur Kochsalzlösung und warum muss man die Wassermoleküle um ein Ion überhaupt speziell mit ‘Solvatschale’ bezeichnen? Es sind doch immernoch einfach nur Wassermoleküle! In der Tat – Wassermolekül ist Wassermolekül, aber die Dynamik zwischen den Wassermolekülen in einer Solvatschale und Wassermolekülen im bulk-Wasser unterscheidet sich. (bulk-Wasser bezeichnet an dieser Stelle reines Wasser, das weit genug von allen Grenzflächen, wie z.B. Gefäßwänden entfernt ist. Leider scheint es im Deutschen keine kurze und sinnvolle Übersetzung dieses Begriffs zu geben.) Betrachten wir zuerst die Wassermoleküle um ein positiv geladenes Natrium-Ion.
Die Wassermoleküle richten sich entsprechend ihrer Partialladung mit dem Sauerstoffatom zum Ion aus, während die Wasserstoffatome vom Ion wegzeigen und Wasserstoffbrückenbindungen bilden können. Beim negativ geladenen Chlorid-Ion ist es umgekehrt: Eines der Wasserstoffatome richtet sich zum Chlorid-Ion aus, während das Sauerstoff-Atom vom Ion wegzeigt. Das zweite Wasserstoffatom wird für die Bildung von Wasserstoffbrückenbindungen mit anderen Wassermolekülen in der Umgebung benutzt. Man kann sich vorstellen, dass auf diese Weise ‘fixierte’ Wassermoleküle nicht mehr gleich schnell rotieren und neue Bindungen ausbilden, wie Wassermoleküle im bulk-Wasser. Dieses Bild der ‘fixierten Wassermoleküle’ um ein Ion ist genau das, was die Gruppe um Huib Bakker in den Niederlanden durch Messungen untermauert hat. Die Wissenschaftler untersuchten die ‘Steifigkeit’ des Wasserstoffbrücken-Netzwerks im bulk-Wasser und in der Umgebung von Ionen. Das Ergebnis ist eine um mehr als den Faktor zwei verlangsamte Dynamik der Wassermoleküle um ein Anion (im obigen Beispiel wäre dies das Chlorid-Ion, in der Studie waren es Perchlorat-Ionen: ClO4–(aq)). Des Weiteren schätzten die Wissenschaftler die Menge der Wassermoleküle ab, die von der Anwesenheit der Ionen beeinflusst werden, mit dem Ergebnis, dass lediglich Wassermoleküle in der ersten Solvatschale eine verlangsamte Dynamik aufweisen.
Gut, also wissen wir jetzt, dass Wassermoleküle um Ionen und Fremdmoleküle eine andere Dynamik aufweisen, als Moleküle bulk-Wasser. Was erklärt uns das nun? Ich habe zwei Gründe im Angebot, warum man dieses Wissen zumindest spannend vielleicht sogar nützlich finden kann – ein Grund entspringt eher der Neugier, der andere ist etwas anwendungsorientierter.
Mit dem oben angesprochenen Konzept der Dynamik von Wassermolekülen in der Solvatschale kann man sich auf molekularer Ebene erklären, warum z.B. sehr hoch konzentrierte Salzlösungen wesentlich viskoser sind als reines Wasser. Bei hohen Konzentrationen befinden sich fast alle Wassermoleküle in der Solvatschale von Ionen und entsprechend ist die Dynamik des Aufbrechens und Neuformierens von Wasserstoffbrückenbindungen zwischen den Wassermolekülen verlangsamt und damit auch das Fließverhalten der Lösung. Zumindest ich finde es faszenierend und irgendwie befriedigend mir eine mit bloßen Augen beobachtbare Größe auf der molekularen Ebene erklären zu können.
Der zweite Grund ist etwas abstrakter, aber vielleicht weniger von Neugier, als von Nutzen getrieben. Mit dem Wissen um die veränderte Dynamik von Wassermolekülen in der Nähe von Fremdkörpern verstehen wir wesentlich besser, welche Rolle Wasser bei chemischen Reaktionen an Enzymen spielt. Enzyme sind in der Regel Proteine, die im Körper ganz bestimmte chemische Reaktionen sehr effizient ablaufen lassen, sie operieren als Katalysatoren. Allerdings wirkt nicht die gesamte Oberfäche des Proteins als Katalysator, sondern nur ein kleiner Bereich, der zudem noch in einer Art ‘Tasche’ in der Struktur des Proteins verborgen sein kann. Um die erwünschte chemische Reaktion am Protein ablaufen zu lassen, müssen zuerst die Ausgangsstoffe zur entsprechenden Stelle des Proteins transportiert werden. Im Anschluss müssen die Reaktionsprodukte auch wieder abtransportiert werden, bevor ein weiteres Ausgangmolekül umgesetzt werden kann. Diese Transportprozesse finden alle in wässriger Lösung statt und entsprechend bestimmt die Dynamik der Wassermoleküle um das Protein und um die Ausgangsstoffe / Reaktionsprodukte mit über die Geschwindigkeit der chemischen Reaktion. Je schneller die Dynamik der Wassermoleküle in der entsprechenden Region ist, um so schneller der Stofftransport. Wollen wir also Reaktionen in wässriger Lösung durch Katalyse effizienter gestalten, sollten wir im Auge behalten, wie der Katalysator strukturiert ist und wie sich das auf die Solvatschale auswirkt. Ich behaupte nicht, dass dieses Wissen aktuell schon viel Anwendung findet, aber es ist ein Thema, das vor allem in Simulationen zur Zeit Aufmerksamkeit genießt.
Von diesem Exkurs zurück in die ‘Wirklichkeit’ zu unserem Kochtopf voll Salzwasser. Ich hoffe euch zwei Dinge näher gebracht zu haben: Einmal, dass das langweilige, kleine Moleküle aus dem wir größtenteils bestehen noch sehr viele ungelöste Fragen aufwirft und zweitens, dass jeder zu Hause die Dynamik von (einigen) Wassermolekülen mit einer Prise Salz beeinflussen kann.
Wen das Thema interessiert (und wer Zugang zu den Fachartikeln hat), kann in den folgenden beiden Fachartikeln mehr erfahren:
‘Analysis of Water in Confined Geometries and at Interfaces’, M. D. Fayer & N. E. Levinger, Annual Review of Analytical Chemistry 3, 89 (2010)
‘Negligible Effect of Ions on the Hydrogen-Bond Structure in Liquid Water’, A. M. Omta, M. F. Kropman, S. Woutersen, H. J. Bakker, Science 301, 347 (2003)











Kommentare (17)