 Dieser Artikel ist Teil des ScienceBlogs Blog-Schreibwettbewerb 2018. Informationen zum Ablauf gibt es hier. Leserinnen und Leser können die Artikel bewerten und bei der Abstimmung einen Preis gewinnen – Details dazu gibt es hier. Eine Übersicht über alle am Bewerb teilnehmenden Artikel gibt es hier. Informationen zu den Autoren der Wettbewerbsartikel finden sich in den jeweiligen Texten.
Dieser Artikel ist Teil des ScienceBlogs Blog-Schreibwettbewerb 2018. Informationen zum Ablauf gibt es hier. Leserinnen und Leser können die Artikel bewerten und bei der Abstimmung einen Preis gewinnen – Details dazu gibt es hier. Eine Übersicht über alle am Bewerb teilnehmenden Artikel gibt es hier. Informationen zu den Autoren der Wettbewerbsartikel finden sich in den jeweiligen Texten.
——————————————————————————————————————
(Un)natürlich Blond – Das Bleichen von Haaren
von Kathleen Raap
Ich, Kathleen, natürliche Blondine, bin Schülerin in Stade und mache in meiner Freizeit Musik und Sport. Durch das Seminarfach „Farben und Farbstoffe“ an unserer Schule bin ich auf Naturwissenschaften aufmerksam geworden.
Wer kennt sie nicht? Die berühmten wasserstoffblonden Haare, die für viele Frauen das Schönheitsideal sind. Doch warum eigentlich „wasserstoffblond“? Das habe auch ich mich gefragt und mich dann spontan für das „Bleichen von Haaren“, also die Blondierung, als Thema für meine Seminarfacharbeit entschieden. Die Entstehung von Haarfarbe allgemein wird dort erklärt, die Inhaltsstoffe des Blondiermittels thematisiert und das Geheimnis von deren chemischer Wirkung gelüftet.

Durch ihren Film „Natürlich Blond“ ist Reese Witherspoon zum Inbegriff der typischen Blondine geworden Urheber Eva Rinaldi , Creative Commons Attribution-ShareAlike 2.0 Generic (CC BY-SA 2.0)
Die Entstehung der Farbigkeit
Um verstehen zu können, warum beispielsweise braune Haare tatsächlich braun sind, sollte man zuerst die allgemeine Farbentstehung nachvollziehen.
Da in unseren Haaren Pigmente, die Melanine, für die Farbentstehung verantwortlich sind, wird das Prinzip der sogenannten Remission angewendet.
Weißes Licht, das aus Lichtwellen aller Längen des sichtbaren Farbspektrums besteht, trifft auf die Farbpigmente und wird durch sie beeinflusst: Bestimmte Wellenlängen werden aufgenommen, also absorbiert, der Rest wird reflektiert und bildet unseren eigentlichen Farbeindruck. Eine meiner wichtigsten Quellen zur Remission
Absorption bedeutet hier die Anregung der π-Elektronen innerhalb der Pigmentmoleküle. Hört sich kompliziert an – ist es aber gar nicht. Innerhalb eines Pigmentmoleküls liegen Doppel- und Einfachbindungen in bestimmten Strukturen abwechselnd, also konjugiert vor. Doppelbindungen setzen sich aus zwei Bindungstypen zusammen: Einer sogenannten Sigma-Bindung, die „stark“ ist und bei Reaktionen bestehen bleibt, und einer π-Bindung. Diese kann sich während einer Reaktion lösen, um eine neue Bindung herzustellen. Es handelt sich bei Pigmenten um ein delokalisiertes π-Elektronensystem, was bedeutet, dass die π-Elektronen innerhalb der Bindungen beweglich sind. Durch die Absorption von Lichtwellen können die π-Elektronen auf ein höheres Energieniveau angehoben werden und bewegen sich weiter zu den Atomen hin. Die Elektronen werden „angeregt“ und eine Absorption findet statt.
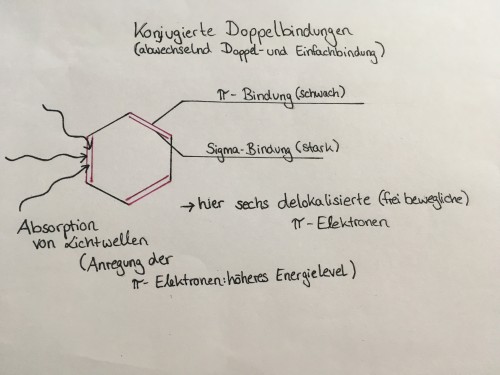
Hier könnt ihr noch einmal den Aufbau eines π-Elekronensystems an einem Beispiel sehen. Jedoch muss beachtet werden, dass dies ein Modell ist und die Molekülstruktur in der Wirklichkeit Abweichungen zeigt, die wegen der Kompliziertheit weggelassen werd
Welche spezifischen Lichtwellen absorbiert werden, hängt von der Anzahl der Doppelbindungen ab: Je mehr davon vorhanden sind, desto längere, energieärmere Wellen werden absorbiert. Dementsprechend wird bei weniger Doppelbindungen innerhalb des Moleküls mehr Energie benötigt, um die π-Elektronen anzuregen: Es werden folglich kürzere, energiereichere Lichtwellen aufgenommen. Melanin im Speziellen absorbiert Lichtwellen über das gesamte sichtbare Farbspektrum, was zur Folge hat, dass die Haare dunkler erscheinen, je mehr Melanin vorhanden ist. Es werden nahezu keine Lichtwellen reflektiert.
Die chemischen Reaktionen der Blondierung und deren Wirkung
Doch was passiert jetzt eigentlich bei der Blondierung und wie können die Haare anschließend hell sein?
Die Hauptbestandteile von Blondiermittel sind Ammoniak-Lösung und Wasserstoffperoxid. Die Ammoniak-Lösung dient einerseits als Alkalisierungsmittel, um das Haar auf die anschließenden Reaktionen vorzubereiten. Andererseits ist es Voraussetzung für die Blondierungsreaktionen: Das Wasserstoffperoxid oxidiert das Melanin, weshalb die Farbigkeit des Pigments verhindert wird.
Im ersten Schritt der Blondierung dissoziiert die Ammoniak-Lösung. Sie löst sich sozusagen in ihre Bestandteile, die Hydroxid-Ionen und Ammonium-Ionen auf:
Die Hydroxid-Ionen sorgen für ein alkalisches Milieu, sodass sich die Schuppenschicht der Haare, Cuticula genannt, abspreizt und das Wasserstoffperoxid anschließend freie Bahn zum Melanin unter dieser Schutzschicht hat.
Durch die Alkalität werden nun auch die Reaktionen mit dem Wasserstoffperoxid in Gang gesetzt: Während das Wasserstoffperoxid in Sauerstoff und Wasser zerfällt, entsteht ein chemisches Gleichgewicht:
Wasserstoffperoxid reagiert mit den Hydroxid-Ionen aus der obigen Reaktion zu Hydroperoxid-Anionen und Wasser.
Von den entstandenen Hydroperoxid-Anionen hängt nun das Blondierungsergebnis ab: Sie oxidieren die Melanin-Moleküle, die für unsere natürliche Haarfarbe zuständig sind. Über mehrere Zwischenschritte wird die ehemalige Struktur dieser Moleküle dabei so verändert, dass die natürliche Haarfarbe nicht mehr zustande kommen kann.
Eine meiner wichtigsten Quellen zur Reaktion

Hier zwei Impressionen von meinem selbst durchgeführten Experiment: Haare am Beginn einer Blondierung mit Wasserstoffperoxid und die Produkte.
Genaue Informationen über die Auswirkung der neuen Molekülstruktur auf die Farbigkeit der Haare habe ich bei meiner Recherche leider nicht finden können, jedoch habe ich eine Vermutung. Hierfür müssen wir uns die Entstehung der Farbigkeit wieder ins Gedächtnis rufen:
Je mehr konjugierte Doppelbindungen und dementsprechend auch delokalisierte π-Elektronen in einem Pigmentmolekül vorhanden sind, desto längere Lichtwellen kann es absorbieren.
Da bei der Oxidation der Melaninmoleküle eine Vielzahl dieser Bindungen zerstört werden, können nur noch kurze, energiereiche Lichtwellen absorbiert werden. Diese müssen nun so kurz sein, dass sie nicht mehr in dem für uns sichtbaren Farbspektrum liegen, welches von 400 nm bis 750 nm langen Wellen reicht. Somit können alle Lichtwellen aus dem sichtbaren Farbspektrum reflektiert werden und es entsteht die Farbe Weiß- oder auch eben Wasserstoffblond genannt.
Wenn ihr also bei eurem nächsten Friseurbesuch wieder ein paar wasserstoffblonde Kunden im Wartebereich seht, könnt ihr euch dazusetzen, etwas angeben und ihnen erst einmal erklären, was überhaupt mit ihren Haaren passiert. Oder ihr verbindet im Stillen die faszinierende Chemie mit eurem Alltag und freut euch über euer neues Wissen. 🙂












Kommentare (8)