Dieser Gastartikel ist ein Beitrag zum ScienceBlogs Blog-Schreibwettbewerb. Alle eingereichten Beiträge werden im Lauf des Septembers hier im Blog vorgestellt. Danach werden sie von einer Jury bewertet. Aber auch alle Leserinnen und Leser können mitmachen. Wie ihr eure Wertung abgeben könnt, erfahrt ihr hier.
Dieser Beitrag wurde von Sebastian eingereicht.
———————————————————————————————————————–
Ach ja, ich liebe es, mich mit den trivialen Dingen der Welt auseinandersetzen zu können. Umso mehr stellt sich mir immer wieder die Frage, wieso ich mich für ein Physikstudium entschieden habe.
Wahrscheinlich wegen dieses blöden inneren Dranges, die Welt erklären zu wollen.
Physik ist dafür aber erstmal eine ganz schlechte Anlaufstelle. Denn was ich mittlerweile festgestellt habe ist, dass das Studium am laufenden Band mehr Fragen aufwirft, als es beantwortet.
Dabei geht es mir in erster Linie um die Frage: „Wie funktioniert das?“
Die Frage wird sich wohl auch Sir Isaac Newton im klangvollen Jahr 1666 gestellt haben, als er zum ersten Mal ein Glasprisma benutzt hat, um Licht in seine Spektralfarben zu zerlegen.
Das Spektrum, in dem wir Licht sehen können, erstreckt sich von niederfrequenterem, rotem Licht, bis hin zum höherfrequenterem, violettem Licht. Kommen die ganzen Frequenzen zusammen, entsteht das „weiße“ Licht, das z.B. auch die Sonne abstrahlt.
Man kann dieses weiße Licht allerdings auch wieder in seine Spektren zerlegen, in dem man es z. B. durch ein Prisma jagt.
Um zu verstehen, was im Prisma passiert, schauen wir uns mal den Begriff des Brechungsindex an.
Der Brechungsindex ist der Faktor, um den die Wellenlänge und die Phasengeschwindigkeit des Lichts kleiner ist, als sie es im Vakuum wäre (die Phasengeschwindigkeit gibt im Prinzip die Ausbreitungsgeschwindigkeit der Welle an). Das führt dazu, dass der Lichtstrahl abgelenkt wird, sobald er von einem Medium in ein anderes (mit unterschiedlichem Brechungsindex) gelangt.
Die englischsprachige Wikipedia gibt ein wunderschönes Beispiel zu diesem Effekt:
Das Plastik hat einen höheren Brechungsindex als die Luft drum herum, weshalb das Licht abgelenkt wird. Im Wasser kann man einen ähnlichen Effekt beobachten. Jeder der schon Mal im Schwimmbecken von oben auf seine Beine geschaut hat, wird diesen Effekt kennen.
So, kommen wir aber mal wieder zurück zum Prisma. Wie oben schon beschrieben, besteht Licht nicht nur aus einer Wellenlänge, sondern aus mehreren unterschiedlichen. Und jede dieser Wellenlängen hat einen unterschiedlichen Brechungsindex.
Trifft das Licht nun leicht schräg auf ein Prisma, so wird das Licht gebrochen und jede Wellenlänge wird in einem anderen Winkel abgelenkt. Dies führt zur Entstehung des Regenbogens auf der Austritts Seite. Pink Floyd hat den Effekt auch mal sehr anschaulich dargelegt.
![By Suidroot (Own work) [GFDL (https://www.gnu.org/copyleft/fdl.html) or CC-BY-SA-3.0-2.5-2.0-1.0 (https://creativecommons.org/licenses/by-sa/3.0)], via Wikimedia Commons](https://scienceblogs.de/astrodicticum-simplex/files/2014/09/Bild-2.png)
By Suidroot (Own work) [GFDL (https://www.gnu.org/copyleft/fdl.html) or CC-BY-SA-3.0-2.5-2.0-1.0 (https://creativecommons.org/licenses/by-sa/3.0)], via Wikimedia Commons
(Ja, ich weiß, das Cover von ‚The Dark Side of the Moon‘ sieht anders aus, aber irgendwie war mir das Thema mit dem Copyright nicht geheuer, also hab‘ ich mich für diese Variante entschieden. Ist aber auch ganz hübsch, würde ich sagen.)
Das rote Licht, welches den oberen Abschluss des Regenbogens bildet, besitzt eine etwas niedrigere Frequenz und wird deshalb in einem etwas flacheren Winkel abgelenkt.
Da das violette Licht die höchste Frequenz des sichtbaren Spektrums besitzt, wird es auch am stärksten abgelenkt, weshalb es den unteren Abschluss des Regenbogens bildet.
Tja, soweit, so einfach. Wo wäre denn der Spaß, wenn das schon alles gewesen wäre?
Schauen wir uns also mal die Errungenschaften einiger, weiterer großer Männer an.
Im nicht ganz so klangvollen Jahr 1859, also 193 Jahre nach Newtons Entdeckung, zeigten die Wissenschaftler Gustav Robert Kirchhoff und Robert Wilhelm Bunsen, den Effekt der Flammenfärbung.
Grundlage für die Arbeit war die Entdeckung von Joseph von Fraunhofer, der einige Jahre zuvor dunkle Linien im Spektrum der Sonne zeigte (die sogenannten Absorbtions- bzw. Fraunhoferlinien).
Diese Flammenfärbung ist die Eigenschaft eines Elements bei der Verbrennung in farblosen Flammen, unterschiedliche, spezifische Wellenlängen (sprich: Farbiges Licht) abzugeben. Diese Wellenlängen sind charakteristisch für jedes einzelne Element. Im Umkehrschluss bedeutet das, kennt man diese Wellenlängen, kann man Rückschlüsse auf das Element ziehen.
Der Effekt der Flammenfärbung beruht auf der Umwandlung von Wärme- zu Strahlungsenergie. Dabei werden die Valenzelektronen durch Wärme angeregt, und geben Licht ab, wenn sie wieder in den Normalzustand zurückfallen.
Dieses abgegebene Licht, macht sich im Spektrum als sogenannte Emissionslinie bemerkbar.
Im folgenden Beispiel sieht man zwei unterschiedliche Spektren. Das obere stammt von einer Calciumprobe. Das Element, das im unteren Spektrum gezeigt wird, konnte ich leider nicht eindeutig bestimmen.
In diesem Bild sieht man besonders schön die unterschiedlichen Emissionslinien, die für jedes Element charakteristisch sind, hervorstechen.
Da wir nun ausreichend mit der Theorie gewappnet sind, ist es an der Zeit, diese auf den praktischen Versuch anzuwenden.
Dafür nehmen wir uns das Spektrometer zur Hilfe.
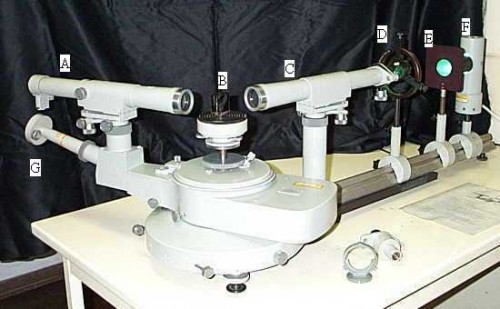
Prismenspektrometer CC-by-sa 2.0/de
Oliver Kurmis – Bild selber aufgenommen 2000 im Physik-Grundpraktikum an der Uni-Jena.
Hier sehen wir ein Prismenspektrometer in freier Wildbahn. Ist es nicht prachtvoll?
Der Aufbau des Spektrometers lässt sich eigentlich auf 3 wesentliche Teile herunterreduzieren.
Das Fernrohr, der Prismentisch und das Spaltrohr. Gehen wir mal den Weg, den das Licht zurücklegt. Das Licht wird in diesem Fall in einer Gasentladungslampe (F) erzeugt. Diese Lampe ist im Prinzip eine mit Gas gefüllte Röhre. Das Gas wird durch die Zufuhr einer gewissen Mindestspannung ionisiert, dabei strahlt es Licht ab. Dummerweise wissen wir nicht, welche Elemente in unserer Lampe enthalten sind, genau das gilt es mit diesem Versuch also zu bestimmen. Das Licht wandert durch das Spaltrohr (C) wo es einigermaßen gebündelt wird, über den Prismentisch (B), auf dem das Prisma steht. In diesem wird es (ihr habt es bestimmt schon erraten) in seine Spektralfarben zerlegt. Das Licht-Geschnetzelte wandert nun in das Fernrohr (A), wo wir es beobachten und die einzelnen Spektrallinien erkennen können.
Die Besonderheit an diesen Spektrometern ist die, dass das Fernrohr zum Prismentisch und zum Spaltrohr ABSOLUT exakt ausgerichtet werden muss. Um das zu gewährleisten, hat man insgesamt 22 unterschiedliche Feststellschrauben überall am Gerät angebracht. Und diese gilt es exakt zu justieren. Die Anleitung zur Justierung des Spektrometers füllt übrigens einen kompletten Ordner aus. Den Ordner durchzuarbeiten und das Gerät einzustellen ist ja an sich schon eine ordentliche Aufgabe. Aber hey, als angehender ‚Bachelor of Science‘ (Danke, Bologna-Prozess…) muss eine richtige Herausforderung her!
Der Raum in dem der Versuch durchgeführt werden muss, ist der Optik-Raum. Dort wird, wie der Name es schon verrät, gerne mal mit Licht und Lasern gearbeitet, was zur Folge hat, dass der Raum dunkel ist. Nicht nur ein bisschen Dunkel, sondern finster. So finster, dass man sich nur mit Hilfe von Taschenlampen durch den Raum bewegen kann. Mein Laborpartner und ich mussten also in einem finsteren Raum im Schein von zwei Taschenlampen eine fummelige Arbeit an einem Spektroskop verrichten, während wir die Montageanleitung (so wie die Blätter aussahen war ich doch verwundert, keine altdeutsche Schrift vorzufinden) in einem Ordner befolgten.
Um zu prüfen, ob alles zueinander exakt eingestellt wurde, mussten wir auch regelmäßig die Gasentladungslampen anschmeißen und einen Blick ins Spektrometer werfen. Es macht unheimlichen Spaß, in einem sehr dunklen Raum in eine sehr, sehr helle Lichtquelle zu schauen.
So ein neues Spektrometer ist garantiert so gebaut, dass die Schrauben ihre vorgesehen Funktion zur Stabilisierung und Ausrichtung des Geräts erfüllen. Unser Spektrometer hatte allerdings gewisse Abnutzungserscheinungen vorzuweisen, was dazu führte, dass jeder Stoß gegen den Tisch zur Folge hatte, dass das Spaltrohr wieder den Abflug aus der eingestellten Position machte und wild in der Gegend rumluderte.
Man lernt seine Kommilitonen erst wirklich zu hassen, wenn man mit ihnen im Labor gearbeitet hat. Ich kann gar nicht aufzählen, wie oft ich im Laufe dieses Versuches die Lust hatte, meine Kommilitonen mit dem Spektroskop zu bewerfen.
Es benötigt die Selbstbeherrschung eines Zen-Meisters, gepaart mit der Ruhe und Ausdauer des Kontinentaldrifts, um diesen Versuch angemessen zu einem positiven Ende zu führen. Zum Glück bin ich mit beidem gesegnet. Und trotz allem bin ich so bescheiden geblieben. Ich bin wundervoll.
Aber wie es öfter der Fall ist, Rückblickend betrachtet, war alles nur halb so wild.
Selbst die Fummelei am Spektrometer ist im Nachhinein gar nicht mehr so schlimm.
Ich kann sogar den letztendlichen Erfolg des Versuches vermelden. Es ist uns gelungen, die unbekannte Lichtquelle als Cadmium-Quecksilber-Lampe zu identifizieren.
Was meine Kommilitonen angeht: Die haben in 2 Wochen genau denselben Versuch. Und dasselbe Spektrometer.
Als ich den Versuch zum ersten Mal grob überflogen habe, war ich wenig begeistert darüber, eine langweilige Wellenlängenbestimmung durchführen zu müssen. Allerdings war diese Unlust durchaus unbegründet, denn der Versuch entpuppte sich als Paradebeispiel für das, was mich an der Physik so reizt. Ich liebe diese interdisziplinären Phänomene, wenn z.B. Optik plötzlich auf Atomphysik trifft. Dieser Moment der Erkenntnis, dass hinter scheinbar einfachen Dingen, so viel mehr stecken kann.
Die kleinen Phänomene, die man im alltäglichen Leben praktisch nicht wahrnimmt, die einem aber, sofern man sie denn kennt, einen Einblick geben, wie die Welt funktioniert, sind mit ein Grund, warum ich mich für dieses Studium entschieden habe.
Mir fällt es wirklich überraschend schwer, diese Faszination in Worte zu fassen, aber vielleicht weiß der ein oder andere ja, wovon ich rede.


![By ajizai [Public domain], via Wikimedia Commons](https://scienceblogs.de/astrodicticum-simplex/files/2014/09/Bild-1-500x332.png)
![By NASA [Public domain], via Wikimedia Commons](https://scienceblogs.de/astrodicticum-simplex/files/2014/09/Bild-3-500x233.jpg)










Kommentare (24)