Hinweis: Dieser Artikel ist ein Beitrag zum ScienceBlogs Blog-Schreibwettbewerb 2015. Hinweise zum Ablauf des Bewerbs und wie ihr dabei Abstimmen könnt findet ihr hier. Informationen über die Autoren der Wettbewerbsbeiträge findet ihr jeweils am Ende der Artikel.

——————————————
Letztens hab ich mal wieder Neuromancer von William Gibson gelesen, ein dystopischer Roman aus dem Jahre 1984. Und wie bei solchen Science-Fiktion-Lektüren nunmal üblich ist die Vorstellung der Zukunft geprägt von anarchischer Gewalt, einem allumfassenden Internet (im Buch “Cyber Space” genannt) und Cyborg-Menschen mit allerlei Prothesen. So verfügt eine der Nebencharaktere nicht nur über ausfahrbare Krallen wie Wolferine, sondern auch über Insekten-ähnelnde Augenmodifikationen. Und das brachte mich auf den Gedanken, ob artifizielle Augen eigentlich irgendwann möglich, weitverbreitet oder überhaupt sinnvoll seien.
Eine erste Internetrecherche zeigt, dass die Idee dafür durchaus vorhanden ist. Das Designer-Studion MHOX bewirbt künstliche Augen, welche ab 2027 das natürliche Augenlicht eines jeden Menschen nicht nur ersetzten, sondern gar verbessern soll. Beim genaueren hinsehen zeigt sich, dass zwar die Idee und ein Vermarktungskonzept vorhanden ist. Die technische Ausführung beruht jedoch auf der naiven Vorstellung, dass mittels Bio-Printing-Methoden in naher Zukunft nahezu alles möglich sein wird. Doch wie könnte den künstliche Sehen technisch realisiert werden?
Augen-Kamera statt Kamera-Auge
Wenn man an künstliche Augen denkt, stellen sich die meisten wohl eine Art Kamera anstelle bzw. innerhalb des Augapfels vor. Eine Kamera hätte, wenn man nur die Pixelzahl mit der Anzahl an Sinnerszellen im Auge vergleicht, in Sachen Auflösung einen klaren Vorteil gegenüber unserem Sehorgan. Das dieser Vergleich sehr hinkt, erklärt Michael von Vsauce sehr gut. Aber gut, ersetzen wir unser Auge durch eine Kamera und stoßen gleich auf das folgen Problem: Wie soll die Bildinformation der Kamera in unser Gehirn gelangen? Einen vielversprechenden Ansatz liefert die Forschung von Dr. Sheila Nirenberg von der Cornwell University. Ihre Gruppe entwickelt Augenprothesen für einige z.B. durch Makuladegeneration erblindete Menschen und es lohnt sich wirklich ein Blick in ihre PNAS-Publikation, ihren TED Talk oder in Irv Arons Blogeintrag darüber. Ich will es euch in etwas geraffter Form erklären.
Im gesunden Auge wird einfallendes Licht an verschiedenen Stellen gebrochen und auf die Netzhaut (Retina) geworfen, die auf der Hinterseite des Auges liegt. In der Retina befinden sich Photorezeptorenzellen und ein dichtes Netz an weiteren Nervenzellen. Es gibt zwei Arten von Photorezeptorzellen, die Stäbchen und die Zäpfchen. Die Zäpfchen erkennen unterschiedliche Wellenlängen und sind für unser Farb- und Kontrastsehen zuständig sind. Die Stäbchen sind deutlich sensitiver gegenüber Licht und für unsere Nachtsicht verantwortlich. Die Rezeptoren geben bei Lichteinfall Signale an den Schaltkreis der Nervenzellen weiter, welcher die eingehende Informationen in eine Abfolge von Impulsen verarbeitet. Diese Impulsfolgen werden an die nachgeschalteten Ganglienzellen weitergeleitet, welche sie wiederum weiter den Sehnerv entlang Richtung Gehirn senden.
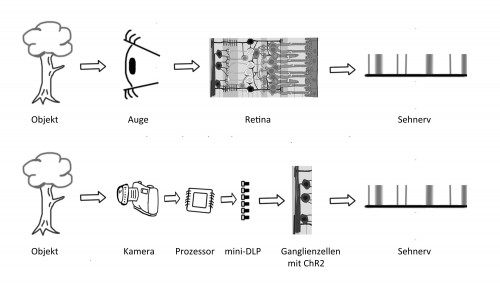
Im gesunden Auge wird das von einem Objekt reflektierte Licht beim Eintritt ins Auge gebrochen und auf die Retina reflektiert. Photorezeptoren und Nervenzellen wandeln das Licht in einen elektrischen Impuls um der an das Gehirn weitergeleitet wird (oben). Bei einer Augenprothese übernimmt eine Kamera und ein Computerchip die Bildaufnahme und -prozessierung. Die errechnete Impulsfolge wird mittels einer Photodiode an modifizierte Ganglienzellen übertragen, die das Lichtsignal in einen elektrischen Impuls umwandeln (unten). (Retinaabbildung abgeändert übernommen von Wikimedia, CC BY-SA 3.0)
Bei Patienten mit Makuladegeneration ist der Bereich der Retina zurückgebildet, wo sich hauptsächlich die Zäpfchen befinden. Mit Nirenbergs Technik sollen nun die zerstörten Rezeptor- und Nervenzellen umgangen werden und die Ganglienzellen direkt angesteuert werden. Der dazu verwendete Ansatz ist zweigeteilt, bestehend aus einem Encoder und einem Transducer. Der Encoder besteht aus einer Kamera, einem Prozessorchip und einem mini-DLP (minidigital ligth projector). Der Prozesserchip soll das Bildmaterial der Kamera in eine geeignete Abfolge von Impulsen umwandeln und damit den natürlichen Schaltkreis der Retina ersetzen. Die errechnete Impulsabfolge wird nun vom mini-DLP als kurze blaue Lichtstöße abgegeben. Auf der Seite der Ganglienzellen kommt nun der Tranducer ins Spiel. Dieser Tranducer ist der Blaulicht-sensitiver Rezeptor Channelrhodopsin-2 (ChR2), der vom Licht der mini-DLP-Diode angeregt wird und das Signal in einen für den Sehnerv verständlichen elektrischen Impuls umwandelt. Um das ChR2-Protein in die Ganglienzellen hineinzubekommen, braucht es jedoch eine gentherapeutische Behandlung des Patienten bzw. des Versuchstieres.











Kommentare (15)