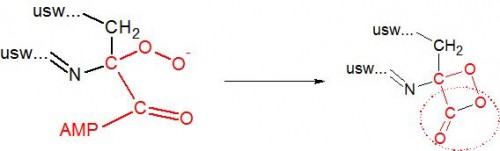
Das vorher negativ geladene Kohlenstoffatom bindet ein vorbeifliegendes Sauerstoffmolekül (O2), das im nächsten Schritt einen Ring bildet. Der eingekreisten Atomgruppe CO2 wird es gleich an den Kragen gehen.
Ringe aus vier Atomen sind sehr instabil, vor allem wenn darin zwei benachbarte Sauerstoffatome vorkommen. Die Bindungen zwischen den Atomen müssen hier plötzlich Winkel bilden, die ihnen eigentlich viel zu klein sind: Es herrscht eine gewaltige Spannung. Die Luciferase greift durch und stellt wieder Ordnung her, indem sie ein Kohlenstoffdioxidmolekül aus dem Ring schneidet und somit eine vereinfachte Version unseres Ursprungsmoleküls erhält, das Oxyluciferin:
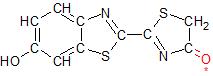
Die Luciferase hat das Luciferin zu Oxyluciferin umgewandelt. Der Stern markiert den angeregten Zustand, in dem das Molekül sich befindet
Und nun kommen wir endlich zum eigentlichen Zweck des ganzen Zaubers: Eines der Elektronen befindet sich noch auf einem Energieniveau, das für die instabilen Zwischenstufen ganz in Ordnung war, aber für unser Oxyluciferin viel zu hoch ist. Es saust sozusagen mit erhöhter Geschwindigkeit durch die Gegend und stellt plötzlich fest, dass inzwischen wieder Ruhe eingekehrt ist: Die Reaktion ist abgeschlossen und wir haben schon das Ortseinfahrtsschild passiert. Das Elektron beruhigt sich und kehrt zu seinem sogenannten Grundzustand zurück.
Dabei wird Energie frei, und diese Energie wird in Form von Licht abgegeben. Da der Unterschied zwischen dem angeregten und dem Grundzustand immer exakt gleich ist, hat das ausgestrahlte Licht auch immer exakt dieselbe Wellenlänge und wir sehen somit immer dieselbe Farbe. Zumindest bei ein und demselben Tier. Im Falle unseres Glühwürmchens liegt die übliche Wellenlänge im Bereich von 550 Nanometer, es leuchtet grün. Das entspricht in etwa einer Energiedifferenz von 2,25 Elektronenvolt, oder 218 Kilojoule pro Mol. Etwas veranschaulicht: Hätten wir 500 Gramm Glühwürmchenluciferin und würden diese komplett zum Leuchten bringen, würden wir bei einer Energie von etwa 390 Kilojoule landen. Mit dieser Energiemenge könnte man zum Beispiel 93 Milliliter Wasser um ein Grad erhitzen – nicht gerade beeindruckend. Vor allem, wenn man bedenkt, dass ein Glühwürmchen nur etwa 200 Milligramm wiegt. Es bräuchte also eine ganze Legion für ein halbes Kilogramm Leuchtstoff.
Für rotes Licht ist noch weniger Energie notwendig, während wir aber ein Stück Eisen auf über 800 °C erhitzen müssten, um eine hellrote Glühfarbe zu erreichen. Kein Wunder, dass die Tierwelt sich einvernehmlich für das kalte Leuchten entschieden hat.
Dass die Lichtfarben der Käfer usnd Quallen, Krebse und Fische, Pilze und Bakterien durchaus sehr unterschiedlich ausfallen, liegt immer an der speziellen Energiedifferenz zwischen angeregtem und Grundzustand. Aus mehreren Gründen variiert diese Differenz: Das Luciferin ist bei jeder Spezies unterschiedlich aufgebaut; die Luciferase des einen Käfers zerrt etwas stärker am Luciferin als die des anderen und sorgt damit für eine leicht unterschiedliche Elektronenenergie; auch der pH-Wert der Umgebung spielt eine Rolle. Manche Tiere machen es sich sogar noch komplizierter und schalten fluoreszierende Substanzen dazwischen, die das erzeugte Licht aufnehmen und in eine andere Farbe konvertieren. Das Grundprinzip ist aber überall dasselbe: Ein Luciferin wird von einer Luciferase erst deprotoniert, dann oxidiert und muss sich danach erstmal wieder abregen.
Leuchtende Ölbaumpilze (Bild: Noah Siegel, CC-BY-SA 3.0)
Die Effizienz dieses Vorgangs lässt dabei jeden LED-Hersteller vor Neid erblassen: Nahezu 100% Lichtausbeute kann der Leuchtkäfer vorweisen. Die Lichtintensität ist dabei freilich nicht so groß: In einem Meter Entfernung kommt pro Quadratzentimeter Rezeptorfläche nicht einmal mehr ein Nanowatt Lichtleistung an. Für die Abendstimmung also super, um den Nachhauseweg zu beleuchten eher nicht.
Jetzt will ich auch leuchten!
Wie wir gesehen haben, ist die Biolumineszenz Ergebnis einer chemischen Reaktion, die in lebenden Organismen stattfindet. Geht das denn auch ohne Käfer, Qualle oder Bakterium? Aber hallo! Ein beliebtes Experiment im Chemieunterricht, das man auch relativ gefahrlos zuhause ausprobieren kann, ist die sogenannte Luminol-Reaktion. Luminol ist ein gelbliches Pulver, das unter ganz ähnlichen Umständen wie das Luciferin zum Leuchten gebracht werden kann:











Kommentare (21)