Ein Team aus Harvard und vom MIT hat dazu wachsende Knochen im Detail analysiert – über die genauen Methoden wie “diffraction phase microscopy” schreibe ich nix, weil ich davon nichts verstehe. Prinzipiell gibt es zwei Möglichkeiten, wie eine Zelle wachsen kann: sie kann Zellflüssigkeit und sonstige Zellbestandteile (im paper unter dem Begriff “dry mass”=Trockenmasse zusammengefasst”) im gleichen Maß wachsen lassen, so dass sich an der prinzipiellen Zusammensetzung der zelle nichts ändert (das ist dann echte Hypertrophie). Oder sie kann bevorzugt Flüssigkeit einlagern – das tun Zellen meist nur dann, wenn irgendeine Krankheit vorliegt. Den Vorgang nennt man “Schwellen” (swelling im Englischen).
Benutzen Chondorcyten nun die echte Hypertrophie oder das Anschwellen, um zu wachsen? Die Antwort lautet: Ja. Sie tun nämlich beides.
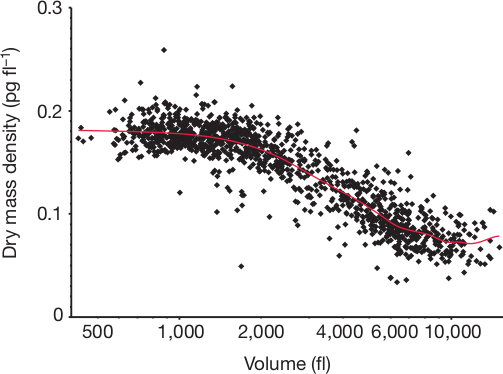
Trägt man den Anteil der Trockenmasse der zelle gegen das Zellvolumen (das ja mit der Zeit immer größer wird) für ein Stück aus einem Mäuseunterschenkel auf, so bekommt man folgenden Plot:
Aus Cooper et al., s.u.
(Die Auftragung ist auf der horizontalen Achse logarithmisch – das ergibt Sinn, weil man so das Wachstum immer auf das aktuelle Volumen bezieht. Die Datenpunkte beziehen sich auf einzelne Zellen, die rote Linie gibt den trend wieder) Man erkennt deutlich drei Phasen: anfangs ist der Prozentanteil der Trockenmasse etwa konstant, während das Volumen zunimmt – das ist also echte Hypertrophie. Dann nimmt erdeutlich ab, hier schwillt der Chnondrocyt also an, indem er Flüssigkeit einlagert. Und in der dritten Phase wächst er dann noch ein bisschen weiter, wobei der Anteil Trockenmasse wieder konstant bleibt.
Aber nicht alle Knochen wachsen gleich schnell. Man kann sich also fragen, wie sich diese unterschiedliche Wachstumsgeschwindigkeit im Zellwachstum bemerkbar macht – werden alle Phasen gleichmäßig gekürzt oder verlängert, oder einige besonders stark?
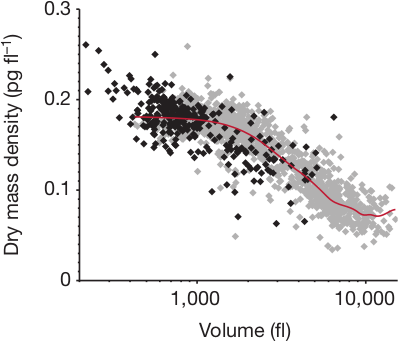
Dazu kann man zum einen unterschiedlich schnell wachsende Knochen von Mäusen anschauen, beispielsweise den Unterarm, der bei Mäusen langsamer wächst. Da sieht man dann folgendes (in hellgrau die Datenpunkte von eben):
Aus Cooper et al., s.u.
Die Chondrocyten im langsamer wachsenden Knochen hören also irgendwo in Phase 2 während des Schwellens auf und bleiben dadurch kleiner.
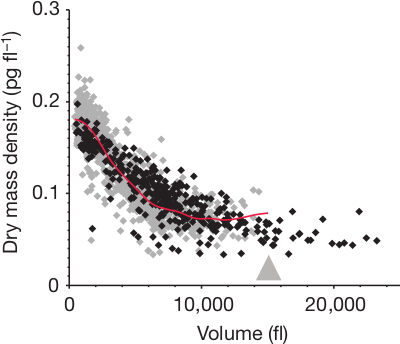
Umgekehrt kann man auch besonders schnell wachsende Knochen angucken – beispielsweise die Mittelfußknochen einer Springmaus mit ihren extrem langen Hinterbeinen. Das sieht dann im Vergleich so aus (diesmal nicht logarithmisch aufgetragen):
Aus Cooper et al., s.u.
Dabei wird also die dritte Phase deutlich in die Länge gezogen, um ein höheres Volumen zu erreichen.
Chondrocyten wachsen also sowohl durch Anschwellen als auch durch echte Hypertrophie; wie stark sie wachsen wird anscheinend dadurch geregelt, wann dieser dreistufige Prozess angehalten wird. (Allerdings nicht nur – Springmäuse haben zusätzlich auch einfach mehr Chondrocyten).
Wie genau der Prozess gesteuert wird, ist noch unklar – man weiß aber, dass dabei ein Wachstumsfaktor namens insulin-like growth factor 1 (Ig f1) eine Rolle spielt. In Mäusen, die einen Mangel an Igf1 haben, und die deshalb kleiner sind, sind auch die Chondrocyten deutlich kleiner, sie wachsen also weniger. Diese Mäuse beenden ihr Chondrocyten-Wachstum am Ende von Phase 2, die letzte Hypertrophie-Phase fällt also weg. Das wiederum ist deswegen interessant, weil es zeigt, dass die erste und die dritte Phase, die ja beide Hypertrophie-Phasen sind, anscheinend unterschiedlich gesteuert werden (sonst müsste die erste Phase bei diesen Mäusen ja auch wegfallen).
Insgesamt verstehen wir jetzt also deutlich besser als vorher, wie genau ein Knochen wächst. Das ist auch vom Standpunkt der Evolution aus interessant – unterschiedliche Knochenproportionen können also relativ einfach dadurch erreicht werden, dass die Wachstumsphase 3 der Chondrocyten beeinflusst wird. Die große Vielfalt der Wirbeltiere mit Größen von der Hummelfledermaus bis zum Blauwal verdanken wir vermutlich also unter anderem dem Mechanismus, mit dem die Chondrocyten gesteuert werden.






Kommentare (17)