In diesem Bild sieht man besonders schön die unterschiedlichen Emissionslinien, die für jedes Element charakteristisch sind, hervorstechen.
Da wir nun ausreichend mit der Theorie gewappnet sind, ist es an der Zeit, diese auf den praktischen Versuch anzuwenden.
Dafür nehmen wir uns das Spektrometer zur Hilfe.
Prismenspektrometer CC-by-sa 2.0/de
Oliver Kurmis – Bild selber aufgenommen 2000 im Physik-Grundpraktikum an der Uni-Jena.
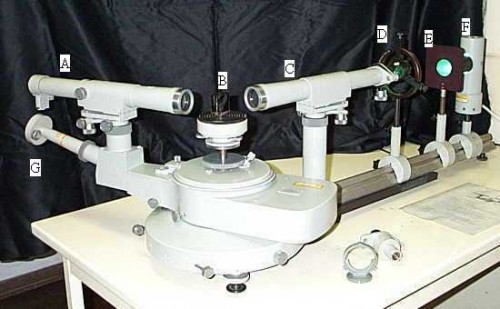
Hier sehen wir ein Prismenspektrometer in freier Wildbahn. Ist es nicht prachtvoll?
Der Aufbau des Spektrometers lässt sich eigentlich auf 3 wesentliche Teile herunterreduzieren.
Das Fernrohr, der Prismentisch und das Spaltrohr. Gehen wir mal den Weg, den das Licht zurücklegt. Das Licht wird in diesem Fall in einer Gasentladungslampe (F) erzeugt. Diese Lampe ist im Prinzip eine mit Gas gefüllte Röhre. Das Gas wird durch die Zufuhr einer gewissen Mindestspannung ionisiert, dabei strahlt es Licht ab. Dummerweise wissen wir nicht, welche Elemente in unserer Lampe enthalten sind, genau das gilt es mit diesem Versuch also zu bestimmen. Das Licht wandert durch das Spaltrohr (C) wo es einigermaßen gebündelt wird, über den Prismentisch (B), auf dem das Prisma steht. In diesem wird es (ihr habt es bestimmt schon erraten) in seine Spektralfarben zerlegt. Das Licht-Geschnetzelte wandert nun in das Fernrohr (A), wo wir es beobachten und die einzelnen Spektrallinien erkennen können.
Die Besonderheit an diesen Spektrometern ist die, dass das Fernrohr zum Prismentisch und zum Spaltrohr ABSOLUT exakt ausgerichtet werden muss. Um das zu gewährleisten, hat man insgesamt 22 unterschiedliche Feststellschrauben überall am Gerät angebracht. Und diese gilt es exakt zu justieren. Die Anleitung zur Justierung des Spektrometers füllt übrigens einen kompletten Ordner aus. Den Ordner durchzuarbeiten und das Gerät einzustellen ist ja an sich schon eine ordentliche Aufgabe. Aber hey, als angehender ‚Bachelor of Science‘ (Danke, Bologna-Prozess…) muss eine richtige Herausforderung her!
Der Raum in dem der Versuch durchgeführt werden muss, ist der Optik-Raum. Dort wird, wie der Name es schon verrät, gerne mal mit Licht und Lasern gearbeitet, was zur Folge hat, dass der Raum dunkel ist. Nicht nur ein bisschen Dunkel, sondern finster. So finster, dass man sich nur mit Hilfe von Taschenlampen durch den Raum bewegen kann. Mein Laborpartner und ich mussten also in einem finsteren Raum im Schein von zwei Taschenlampen eine fummelige Arbeit an einem Spektroskop verrichten, während wir die Montageanleitung (so wie die Blätter aussahen war ich doch verwundert, keine altdeutsche Schrift vorzufinden) in einem Ordner befolgten.
Um zu prüfen, ob alles zueinander exakt eingestellt wurde, mussten wir auch regelmäßig die Gasentladungslampen anschmeißen und einen Blick ins Spektrometer werfen. Es macht unheimlichen Spaß, in einem sehr dunklen Raum in eine sehr, sehr helle Lichtquelle zu schauen.
So ein neues Spektrometer ist garantiert so gebaut, dass die Schrauben ihre vorgesehen Funktion zur Stabilisierung und Ausrichtung des Geräts erfüllen. Unser Spektrometer hatte allerdings gewisse Abnutzungserscheinungen vorzuweisen, was dazu führte, dass jeder Stoß gegen den Tisch zur Folge hatte, dass das Spaltrohr wieder den Abflug aus der eingestellten Position machte und wild in der Gegend rumluderte.
Man lernt seine Kommilitonen erst wirklich zu hassen, wenn man mit ihnen im Labor gearbeitet hat. Ich kann gar nicht aufzählen, wie oft ich im Laufe dieses Versuches die Lust hatte, meine Kommilitonen mit dem Spektroskop zu bewerfen.
Es benötigt die Selbstbeherrschung eines Zen-Meisters, gepaart mit der Ruhe und Ausdauer des Kontinentaldrifts, um diesen Versuch angemessen zu einem positiven Ende zu führen. Zum Glück bin ich mit beidem gesegnet. Und trotz allem bin ich so bescheiden geblieben. Ich bin wundervoll.
Aber wie es öfter der Fall ist, Rückblickend betrachtet, war alles nur halb so wild.
Selbst die Fummelei am Spektrometer ist im Nachhinein gar nicht mehr so schlimm.
Ich kann sogar den letztendlichen Erfolg des Versuches vermelden. Es ist uns gelungen, die unbekannte Lichtquelle als Cadmium-Quecksilber-Lampe zu identifizieren.
Was meine Kommilitonen angeht: Die haben in 2 Wochen genau denselben Versuch. Und dasselbe Spektrometer.

![By NASA [Public domain], via Wikimedia Commons](https://scienceblogs.de/astrodicticum-simplex/files/2014/09/Bild-3-500x233.jpg)










Kommentare (24)