Edelgase bestehen aus Atomen, die sich normalerweise nicht chemisch binden, weil sie eine günstige Anordnung ihrer Elektronen haben (eine “volle Elektronenschale”), die chemische Bindungen energetisch wenig attraktiv machen. (Traktiert man sie mit hinreichend fiesen Reaktionspartnern, können sich aber einige Edelgase wie Xenon doch chemisch verbinden, aber das sind exotische Ausnahmen.) Edelgase haben also eigentlich keine Anziehungskräfte mit anderen Atomen und Molekülen. Trotzdem werden sie flüssig und schließlich (mit Ausnahme von Helium) fest, wenn man sie abkühlt. Auch andere chemisch gesättigte Moleküle bilden irgendwann Flüssigkeiten und Festkörper. Wieso eigentlich? Diese Anziehungskraft beruht auf rein quantenmechanischen Effekten, wird aber gern verwirrend dargestellt.
Schauen wir erst einmal auf die “handelsübliche” Erklärung dieser so genannten van-der-Waals-Kräfte, die zwar die Grundidee richtig darstellt (anders als es einst ein gewisser Chemie-Lehrer tat, der im Chemie-Leistungskurs ernsthaft behauptete, die van-der-Waals-Wechselwirkung beruhe auf Gravitation…), aber leider ein paar Grundlagen der Quantenmechanik ignoriert. Und da ich gerade merke, dass ich gleich einen Schreibkrampf bekomme, kürze ich ab sofort die Wechselwirkung mit vdW-Wewi oder vdW-Kraft ab (und bei meinem momentanen Talent für Tpipfehler werde ich das mit der Groß- und Kleinschreibung auch nicht immer korrekt machen, fürchte ich,). Anmerkung: Ich spreche hier pauschal von vdW-Kräften – man kann auch etwas genauer sein und unterschiedliche Aspekte unterscheiden, dann müsste man von der Londonschen Dispersionswechselwirkung sprechen oder von der vdW-Wewi im engeren Sinne. Details dazu erklärt euch der Quell allen Wissens.
Ein Atom besteht ja aus einem schweren geladenen Kern und einer Elektronenhülle. Im halb-klassische Bohrmodell kreisen die Elektronen wie kleine Planeten um den Atomkern, aber dieses Bild ist zwar anschaulich nett, aber letztlich falsch. Laut Quantenmechanik muss man die Elektronen über ihre Wahrscheinlichkeit beschreiben, sich an einem bestimmten Ort aufzuhalten (wenn ihr mehr über die Grundlagen der Qm lesen wollt, dann klickt rechts bei Artikelserien, da findet ihr ziemlich viel zum Thema…). Man kann sich die Elektronen also als eine Art “Wolke” vorstellen, die das Atom umgibt, so wie in diesem Bild hier (aus einem Buch, das ich sehr empfehlen kann, muhaha):
Da das Elektron sich irgendwo in der Wolke aufhält, kann man sich vorstellen, dass es mal am einen und mal am anderen Ort ist – die Wolke soll ja die Wahrscheinlichkeitsverteilung angeben. Und wenn das so ist, dann kann man sich wiederum vorstellen, dass das Elektron mal auf eher der einen Seite des Kerns sitzt und mal eher auf der anderen.
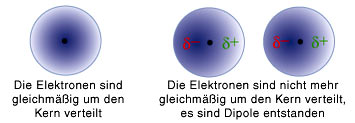
Hat man jetzt zwei Atome nebeneinander, dann sind in jedem dieser beiden Atome die Elektronen in ihren Wolken verteilt. Und wenn man diese Atome jetzt aneinander annhähert, dann ist es energetisch günstig, wenn die Elektronen sich so anordnen, dass das eine Elektron zwischen den beiden Atomkernen ist, das andere aber nicht, so wie in diesem Bild hier:
(Bild von der FU Berlin, Urheberin Mirjam Brockmann, CC License 4.0, wenn ich diesen Hinweis richtig verstehe)
Hier sehen wir, wie sich das Elektron bei beiden Atomen eher etwas weiter links aufhält. Weil der Atomkern positiv geladen ist, ist bei jedem der eigentlich ja elektrisch neutralen Atome die Ladung so verschoben, dass auf der linken Seite etwas mehr negative und auf der rechten Seite etwas mehr positive Ladung zu finden ist. Jedes der Atome bildet damit einen sogenannten elektrischen Dipol. Diese beiden Dipole ziehen sich dann an (weil sich positive und negative Ladung anziehen) und sorgen so für die Kraft zwischen den Atomen.
Nur damit hier keine Missverständnisse aufkommen: Ich mache niemandem einen Vorwurf, der diese Erklärung der vdW-Wewi verwendet. Erstens enthält sie viele richtige Elemente, zweitens steht es so fast überall und drittens muss man manchmal Dinge auch vereinfachen – in dem Link der FU geht es zum Beispiel um Kunststoffe, da will man nicht erst nen Semester Quantenmechanik beibringen. Ich habe die Erklärung auch selbst (allerdings mit dem Hinweis, dass sie vereinfacht ist) verwendet. Hier geht’s nicht darum, dass ich mich über Leute aufregen will, die vereinfachte Erklärungen verwenden, weil das gerade didaktisch sinnvoll ist – aber es schadet ja nix, mal etwas genauer hinzusehen.







Kommentare (66)