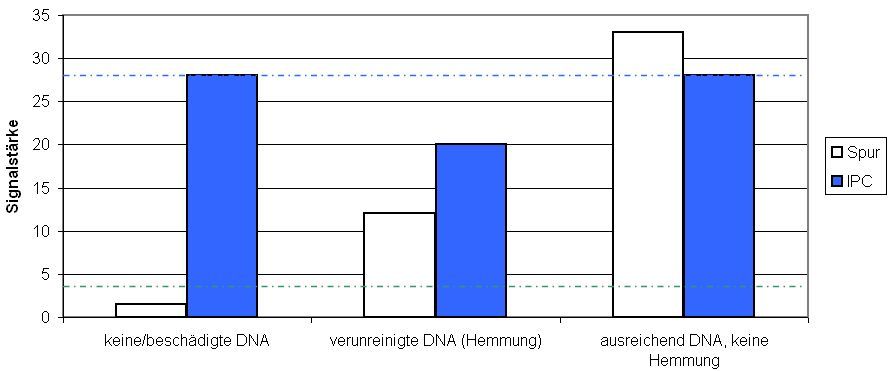
Um auch eine mögliche Verunreinigung mit Inhibitoren entdecken zu können, setzt man jedem Reaktionsgefäß mit einem DNA-Extrakt aus Spurenmaterial noch eine künstliche DNA als interne Positivkontrolle (IPC) zu und führt sie durch alle Schritte unter gleichen Bedingungen mit. Für die Fluoreszenzsignalstärke der IPC am Ende der qPCR gibt es einen genauen und vordefinierten Soll-Wert. Wird dieser nicht erreicht, ist der Reaktionsansatz sehr wahrscheinlich mit Hemmstoffen verunreinigt, die den normalen Ablauf der PCR gestört haben und sich für nachfolgende Analysen mit der Spuren-DNA, z.B. der STR-Multiplex-PCR, als problematisch erweisen können (Abb.1).
STR-Multiplex-PCR zur Erzeugung von DNA-Profilen
Ein besonders aufwendiges und komplexes PCR-Verfahren stellt die STR-Multiplex-PCR dar. Dieses Verfahren ermöglicht die gleichzeitige Vervielfältigung von üblicherweise 17 und mehr „short tandem repeat“(STR)-Systemen und ist die Grundlage für die Erstellung eines individuellen DNA-Profils. Ein STR-System ist ein definierter DNA-Abschnitt, der eine Reihe von kurzen, hintereinander angeordneten Wiederholungen eines nur wenige Basen umfassenden DNA-Motivs umfasst, z.B. AGGA. STR-Systeme liegen in der sogenannten Microsatelliten-DNA, sind über das ganze Genom verteilt ist und jeder Mensch besitzt zwei Kopien, auch als „Allel“ bezeichnet, eines jeden STR-Systems. Diese eignen sich deshalb hervorragend zur Unterscheidung von Personen, weil jede bestimmte Kombination der Anzahlen von Motivwiederholungen in einer Gruppe von acht oder mehr STR-Systemen mit extrem hoher Wahrscheinlichkeit nur in einem einzigen Menschen vorkommt [4].
Um nicht 17 und mehr PCR-Ansätze für alle zu vervielfältigenden STR-Systeme vorlegen zu müssen, wofür ohnehin meist nicht genug DNA-Extrakt zur Verfügung steht, werden alle Ansätze zusammengeführt und zu einer einzigen Multiplex-Reaktion vereinigt. Die Feinabstimmung der Reaktionsbedingungen und biochemischen Parameter für eine PCR, in der 17 und mehr Primerpaare untergebracht werden müssen und die mit möglichst ähnlicher Amplifikationsseffizienz und ohne sich dabei gegenseitig zu behindern funktionieren sollen, stellt eine höchst komplexe, aufwendige Prozedur dar.
Viele forensische Labore verwenden daher kommerziell erhältliche, gebrauchsfertige Zusammenstellungen, sogenannte „Kits“, für die Durchführung von STR-Multiplex-PCR. Solche Kits haben den Vorteil, daß sie sehr zeit- und arbeitsparend eingesetzt werden können, da sie den äußerst hohen gesetzlichen Ansprüchen an die Methodenvalidierung forensischer Labore genügen. Die Primer, die in solchen Kits enthalten sind, sind mit einem von mehreren verschiedenfarbigen Fluoreszenzfarbstoffen markiert. Dies ermöglicht nach Fertigstellung der STR-Multiplex-PCR die Sortierung der dabei entstandenen PCR-Produkte in einem Elektropherogramm: eine Voraussetzung für die Erstellung eines eindeutigen DNA-Profils.
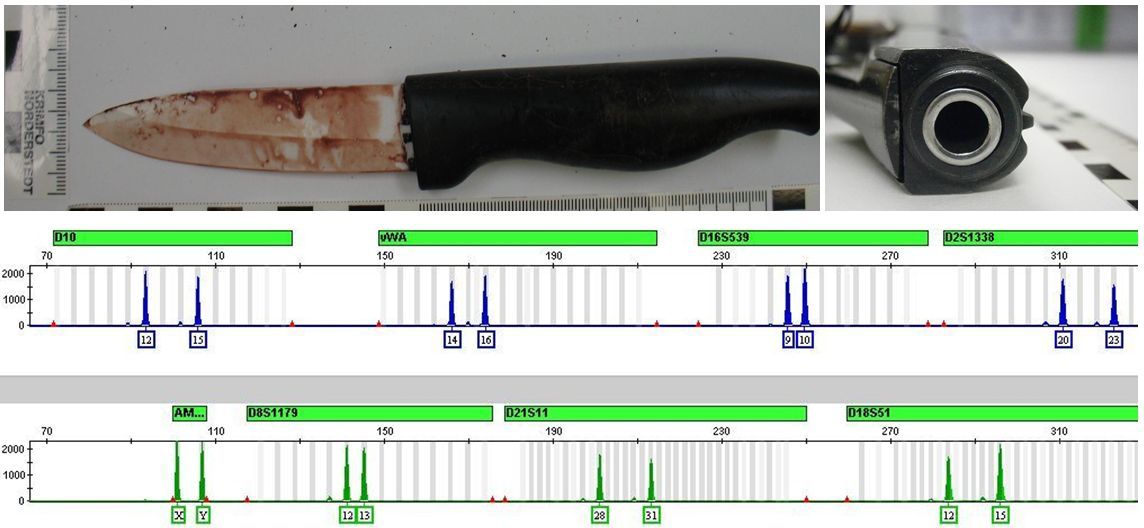
Die Vervielfältigung von STR-Systemen mittels STR-Multiplex-PCR ist derzeit die bedeutendste und weltweit am stärksten verbreitete Methode des DNA-profilings. Außerdem basieren heute alle von Polizeien und anderen Ermittlungsbehörden unterhaltenen DNA-Datenbanken, in denen die Profile von überführten Verbrechern aber auch unbekannten Tatortspuren gespeichert werden, auf STR-basierten DNA-Profilen. Die STR-Multiplex-PCR hat sich bewährt: sie ist ein robustes und verlässliches Verfahren und ermöglicht ein profiling auch noch aus sehr geringen DNA-Mengen von 100 Picogramm. Es ist uns damit vor kurzem sogar gelungen, aus der DNA, die aus dem Inneren von Schußwaffenläufen gewonnen wurde [5], die DNA-Profile der durch diese Waffen getöteten Personen zu erstellen (Abb. 2).
Reverse-Transkription-PCR zur RNA-basierten Spurenartidentifikation
Seit kurzem wird auch die Analyse der Ribonukleinsäure (RNA) in der forensischen Fallarbeit verwendet. Die RNA, genauer die mRNA, ist das direkte molekulare Korrelat der Genexpression und eine quantitative Analyse des momentaufnahmenartigen Bestands der RNA-Moleküle in den Zellen aus biologischem Spurenmaterial, das sogenannte „Transkriptom“, lässt die genaue Bestimmung der Zusammensetzung selbst schwieriger Mischspuren zu [6]. Das ist insbesondere bei der Rekonstruktion von Sexualdelikten von entscheidender Wichtigkeit, da hier Mischspuren aus bis zu fünf oder sechs verschiedenen Spurenarten auftreten können. Zu diesem Zweck müssen mittels PCR bestimmte für eine Spurenart spezifische mRNA-Moleküle nachgewiesen werden.
Die PCR benötigt jedoch grundsätzlich DNA als Ausgangsmaterial. Deshalb muß die aus dem Spurenmaterial gewonnene RNA zunächst in komplementäre DNA (cDNA) umgewandelt oder transkribiert werden. Im normalen „Zellalltag“ verläuft die Transkription aber in die andere Richtung, es wird also DNA zu RNA transkribiert. Aus diesem Grund bezeichnet man die Umschrift von RNA zu cDNA als umgekehrte oder „reverse“ Transkription (RT) und das Enzym, das sie durchführt ist die „Reverse Transkriptase“. Die RT ist dabei nicht einmal annährend so effizient wie die PCR und erzeugt deshalb vergleichsweise große Varianzen im RT-PCR-Verfahren. Wichtiger als die absolute Effizienz der RT ist jedoch, daß sie die Mengenverhältnisse der mRNAs aus der Ursprungspopulation, dem RNA-Extrakt, exakt im Reaktionsprodukt, der cDNA, abbilden kann. Der Nachweis spurenartspezifischer mRNAs wird also indirekt über den Nachweis komplementärer, spurenartspezifischer cDNAs geführt. An die RT schließt sich dann eine PCR zum Nachweis dieser cDNAs an. Dabei handelt es sich entweder um eine qPCR mit fluoreszierenden Sonden (s.o.), wodurch die gesuchten cDNAs in „Echtzeit“ detektiert werden können. Oder man führt eine Standard-PCR mit fluoreszenzmarkierten Primern durch, ganz ähnlich dem STR-Multiplex-Verfahren (s.o.), an die dann die kapillarelektrophoretische Detektion und Identifikation der PCR-Produkte und Darstellung im Elektropherogramm angeschlossen wird (Abb. 3).



Kommentare (5)