Zellen sind mit einem Selbstzerstörungsmechanismus ausgestattet. Dieser kann von außen aber auch von der Zelle selbst, also von innen betätigt werden, wenn irgendetwas mit dieser Zelle gerade gründlich schief läuft oder bereits gelaufen ist. Durch diesen Mechanismus, die sogenannte Apoptose, kann der Schaden für den Gesamtorganismus minimiert werden, indem die beschädigte Zelle gezielt zerstört und entfernt wird. Das ist ein bißchen so, wie einen Apfel mit einer braunen Stelle aus dem Korb mit den noch frischen Äpfeln zu nehmen, welche daraufhin länger halten. Was Apoptose genau ist, ihre intrinsische und extrinsische Einleitung und wie sie funktioniert, habe ich früher schon erklärt und werde es hier deshalb nicht mehr weiter ausführen (,weshalb ich empfehle, die Grundlagen bei Bedarf noch einmal schnell dort nachzulesen). Am Ende des Artikels schrieb ich in Voraussicht auf diese Serie aber bereits, daß den
„Selbstzerstörungsmechanismus zu stoppen, in einer Zelle einen der Grundsteine der Krebsentstehung legen würde“.
Und genau darum soll es nun in diesem Artikel gehen.
Wenn wir noch einmal die Auto-Analogie bemühen wollen, dann hatte unser Katastrophenfahrzeug (= Krebszelle) bereits die Fähigkeit zum unbegrenzten Gasgeben und zur Deaktivierung der Bremsen erlangt. Da unser Auto aber zur Sicherheit noch eine Kontrollschaltung (= Apoptose) in die Bordelektronik eingebaut hat, die den Motor komplett ausschaltet, wenn eine bestimmte Geschwindigkeit überschritten wird oder Sicherheitssysteme wie das ABS ausfallen, muß für eine echte Chaosfahrt auch diese Kontrollschaltung zerstört oder umgangen werden. Und genau das, die Umgehung der oder der Widerstand gegen die Apoptose ist ein weiteres Kennzeichen von Krebs.
Das ist übrigens für eine Krebszelle besonders wichtig, da sie gleich von mehreren Seiten von der Apoptose bedroht sein kann: nicht nur sind einige Chemotherapeutika darauf ausgelegt, die Apoptose auslösen, sondern die chaotische Natur einer Krebszelle selbst kann das bewirken, indem z.B. zu stark exprimierte Onkogene oder durch DNA-Schäden bedingte zu hohe Teilungsraten ebenfalls apoptoseinduzierend wirken können. Daraus wird auch ersichtlich, daß vor allem der intrinsische, also in und von der Zelle selbst ausgelöste Apoptosesignalweg gefährlich für die Krebszelle ist und daß es ihr irgendwie gelingen muß, diesen Signalweg zu unterbrechen oder zu manipulieren.
Ein besonders wichtiger Trick besteht darin, die zellulären Sensorsysteme für Abnormalität zu deaktivieren, die „bemerken“, wenn etwas in der Zelle nicht (mehr) ordnungsgemäß verläuft und das ist in Krebszellen eigentlich dauernd und zunehmend stärker der Fall. Sehr häufig wird eine Krebszelle daher z.B. P53 durch Mutation des entsprechenden Gens, loswerden, da P53 nicht nur Wachstum und Teilung einer Zelle begrenzen (wie hier beschrieben), sondern bei besonders schweren Schäden, z.B. an der DNA, auch gleich die Apoptose auslösen kann.
Im Apoptose-Artikel hatte ich ja erklärt, daß die Apoptose nur ausgelöst wird,
wenn nach Integration aller zellulären pro- und antiapoptotischen Signale der proapoptotische Stimulus überwiegt.
Und genau hier besteht auch eine weitere Möglichkeit für die Krebszelle, die Apoptose zu umgehen, indem sie dieses sensible Gleichgewicht aushebelt und eine so stark erhöhte bzw. erniedrigte Expression von antiapoptotischen (z.B. BCL-2 und BCL-XL) bzw. proapoptotischen (z.B. Bax, Bim, Puma) Regulatoren erzeugt, daß es nach Zusammenfassung aller verfügbaren Signale nicht mehr zu einer „Entscheidung“ für Apoptose kommt.
Aber auch der von außen einwirkende Signalweg der extrinsischen Apoptose ist nicht ungefährlich für eine Krebszelle und man kennt viele Beispiele dafür, wie in Tumorzellen dieser Signalweg „kurzgeschlossen“ wird.
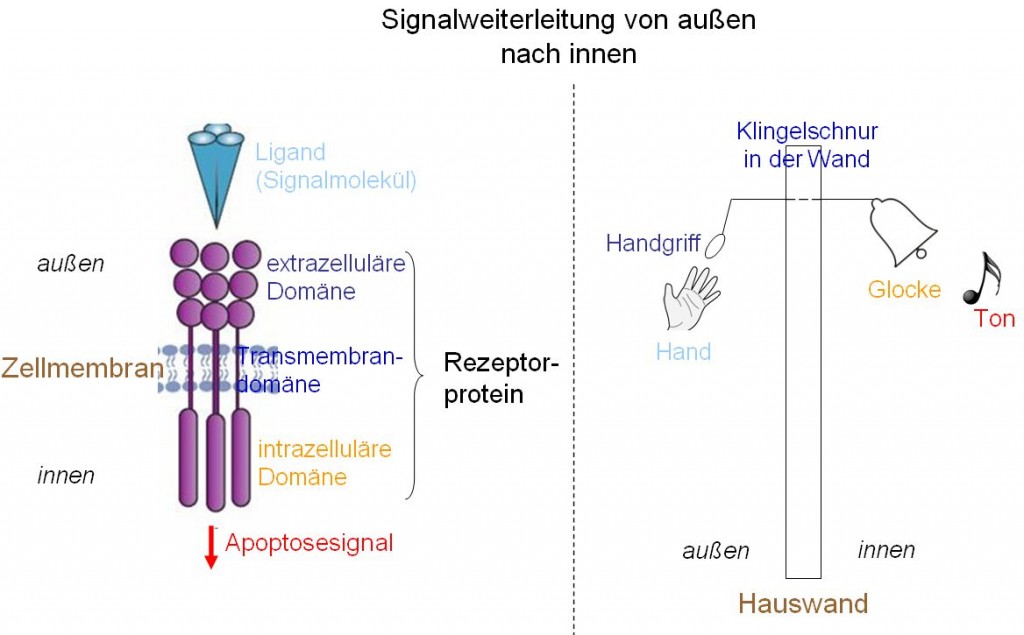
Das Bild zeigt, wie die Weiterleitung von Signalen von außen nach innen funktioniert anhand eines Vergleichs zwischen transmembranären Rezeptorproteinen mit einer einfachen Glockenzugklingel. Dabei entsprechen einander die farblich übereinstimmend beschrifteten Teile. Eine Krebszelle kann nun an verschiedenen Punkten dieses Mechanismus’ eingreifen z.B. indem Rezeptorproteine (von Todesrezeptoren) durch Mutationen die Fähigkeit verlieren, an ihren extrazellulären Liganden zu binden (das wäre, wie den Handgriff zum Ziehen abzumontieren) oder die Fähigkeit, im Inneren der Zelle „bekannt zu geben“, daß außen der Liganden gebunden hat (das wäre, wie die Glocke abzumontieren).
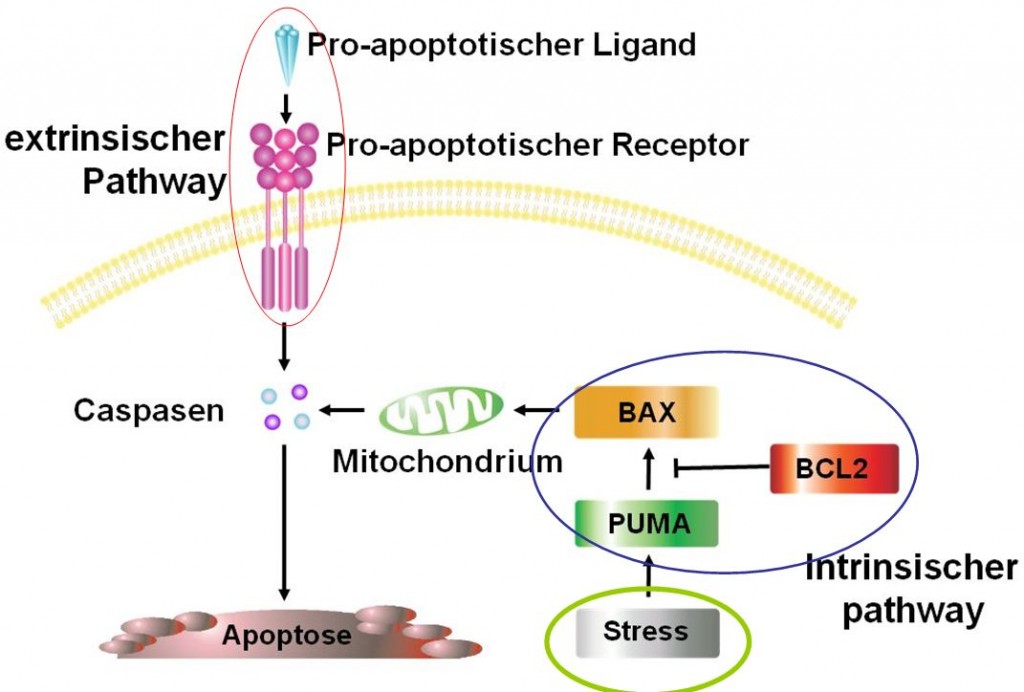
rot: Kurzschließen des extrinsischen Signalwegs
blau: Manipulation der pro- und antiapoptotischen Signale
grün: Lahmlegen der zellulären Abnormalitätssensoren
Im Bild sieht man eine stark vereinfachte Darstellung der beiden Hauptsignalwege (Pathways) für die Apoptose: den extrinischen (von außen einwirkenden) und den intrinsischen (von innen einwirkenden) und ich habe mit farbigen Ovalen markiert, an welchen Stellen die Krebszelle eingreifen kann. Natürlich ist die Wirklichkeit noch viel detailreicher und komplizierter aber man könnte vielleicht sagen, daß die Vielzahl der möglichen Wege, durch welche die Apoptose eingeleitet werden kann mit der Vielzahl der Tricks korrespondiert, die Krebszellen einsetzen, um die Apoptose zu umgehen. Wichtig ist auch, zu verstehen, daß Krebszellen niemals richtig immun gegen Apoptose werden, sondern nur verschiedene Auslöser und Mechanismen der Apoptose lahmlegen oder umgehen können.
Denn gerade weil sie nicht immun gegen Apoptose sind, nutzt man Chemotherapeutika, die mehr oder weniger brutal die Apoptose erzwingen. In den letzten Jahren hat man immer besser verstanden, wie die Apoptose reguliert wird und konnte Medikamente herstellen, die die körpereigenen Apoptoseauslöser exakt nachahmen. Vor kurzem erst berichtete Nature Medicine (Nature Medicine 19, 131–133 (2013)) von einem neuen und interessanten therapeutischen Ansatz, der darin besteht, daß der Wirkstoff ABT-199 die Apoptoseblockade von Krebszellen überwindet, indem er selektiv das antiapoptotische BCL-2-Protein bindet, welches verhindert, daß es zur Destabilisierung der Mitochondrien-Membran und damit zur intrinsisch ausgelösten Apoptose kommt. Besonders Blutkrebszellen verlassen sich häufig auf BCL-2 zur Verhinderung von Apoptose, weshalb ein großes Interesse an diesem Protein besteht. In gesunden Zellen reicht die Blockade von BCL-2 normalerweise nicht aus, um die Apoptose auszulösen, da es noch andere Sicherungssyteme gibt, die das verhindern können (im Apoptose-Artikel gehe ich darauf ein). Weil aber in vielen Krebszellen durch die ihrer Natur gemäßen Abnormalitäten die Tendenz zur Apoptose bereits sehr hoch ist, fällt genau diese Sicherung weg und die Apoptose wird nur noch durch BCL-2 verhindert. Wenn dann BCL-2 durch einen Wirkstoff wie ABT-199 spezifisch gehemmt wird, wird die Krebszelle sozusagen über die Klippe gestoßen. Das Tolle ist, daß dieser Wirkstoff, der bereits gute Ergebnisse in klinischen Studien zeigte, in anderen, normalen Zellen nicht die Apoptose auslöst und damit schwere Nebenwirkungen erzeugt, weil in diesen ja die BCL-2-Sicherung noch funktioniert.
(Die Erkenntnisse um ABT-199 sind übrigens auch für mich persönlich sehr spannend, da ich selber damals in meiner Zeit als Krebsforscher für „meinen“ Tumor, das primäre ZNS-Lymphom (PCNSL), eine starke Überexpression von BCL-2 und damit eine wahrscheinlich eingeschränkte Apoptose nachgewiesen habe. Vielleicht läßt sich ABT-199 auch bei der Behandlung von PCNSL nutzen?).
In der nächsten Folge beschreibe ich, wie Krebszellen die Unsterblichkeit erlangen.
__________________
Übersicht Krebs-Serie:



Kommentare (61)