In der letzten Folge habe ich beschrieben, wie eine Krebszelle zur unbegrenzten Teilungsfähigkeit gelangen kann. Diese Eigenschaft kann sie sehr häufig auch an ihre Tochterzellen weitergeben, so daß rasch ein Klumpen, also ein Tumor von sich rasch teilenden und wiederum sich rasch teilende Zellen hervorbringenden Zellen entsteht. Die Zellteilung ist jedoch ein aufwendiger und sehr energiebedürftiger Prozess und für die Entstehung und das Überleben neuer Zellen bedarf es eines stetigen Nachschubs an Sauerstoff und “Baumaterial”, also den Grundbausteinen für alle Zellen, sowie einer ebenso stetigen Abfuhr von Stoffwechselabfällen und Kohlenstoffdioxid. Dieser An- und Abtransport vollzieht sich über das Blut und durch Blutgefäße, die die Gewebe durchziehen.
Normalerweise findet im ausgewachsenen Menschen keine Neubildung von Blutgefäßen, die sogenannte Angiogenese, mehr statt. Ausnahmen hiervon bilden z.B. Wundheilungsprozesse und Prozesse während des weiblichen Zyklus’. In solchen Fällen wird die Angiogenese vorübergehend eingeschaltet, um neu gebildetes oder heilendes Gewebe mit Gefäßen zu versorgen. In Tumorgewebe hingegen ist der Angiogenese-Schalter (“angiogenic switch”) sehr häufig dauerhaft aktiviert, wodurch aus dem normalerweise ruhenden Gefäßsystem immer neue Abzweige und neue Gefäßarme sprießen, um das stetig wachsende Tumorgewebe zu versorgen. Weil die Feinabstimmung der Steuerung für normale Gefäßneubildung in den Tumoren verloren gegangen ist, sehen in Tumorgewebe gebildete auch ganz anders aus als normale Gefäße: so beobachtet man dort fehlplatziertes Aussprießen von Kapillaren, exzessive Gefäßverästelungen, erratischen Blutfluss, Kleinsteinblutungen, leckende Gefäße, untypisch angeordnete Perizyten und abnorme Proliferation aber auch Apoptose von Gefäßzellen.
Früher dachte man daher, daß Angiogenese nur in großen und weit fortgeschrittenen Tumoren aufträte. Inzwischen gibt es aber neuere Belege, die zeigen, daß sie bereits früh in den mikroskopisch kleinen Vorstufen bösartiger Tumore (Dysplasien und Neoplasien) auftritt und sie damit als genuines Kennzeichen von Krebs gelten kann. Wenn wir noch einmal die Auto-Analogie aus vorherigen Folgen bemühen wollen, dann entspräche solch eine Selbstversorgung eines Tumors durch Gefäßneubildung am ehesten einem eigenen Tanklaster, der unser außer Kontrolle geratendes Auto begleitet und über einen Tankschlauch während der Fahrt sein überaus „unwirtschaftliches“ Fahrverhalten mit stetiger Kraftstoffzufuhr ermöglicht.
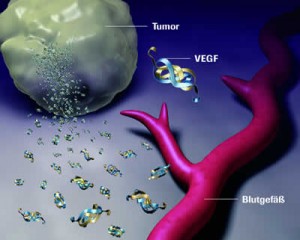
Analog zur Apoptose beruht auch die „Entscheidung“ darüber, ob neue Gefäße gebildet werden sollen oder nicht, im Körper auf einem dynamischen Gleichgewicht entgegengesetzt wirkender also pro- und antiangiogenetischer Einflüsse oder Regulatoren. Einige wichtige angiogenetische Regulatoren sind Signalproteine, die an passende Proteine auf den Zelloberflächen (sog. Rezeptoren) von Gefäßzellen (vaskuläre Endothelzellen) binden und dadurch in den Zellen eine das Gefäßwachstum hemmende oder stimulierende Reaktion erzeugen. Besonders gut beschrieben sind hier die Proteine VEGF-A (stimulierend) und TSP-1 (hemmend).
VEGF-A sorgt für eine Neubildung aber auch den Erhalt von Blutgefäßen und kann dazu an drei verschiedene Rezeptoren (VEGFR-1-3) binden. Die VEGF-A-vermittelete Signalübertragung über diese drei Rezeptoren wird dabei noch auf mehreren Ebenen gesteuert und reguliert, woraus ersichtlich wird, wie komplex die Kontrolle dieses Prozesses wirklich ist. Viele Tumorzellen „lernen“ aber, wie sie das Gen für VEGF-A überexprimieren und somit mehr VEGF-A-Protein herstellen können, als normal wäre.
Ähnliches wurde auch schon für andere proangiogenetische Signalmoleküle wie z.B. Mitglieder der FGF-Familie beobachtet. Insgesamt führt die übermäßige Herstellung solcher Signalmoleküle dann zu einer erhöhten und abnormen Gefäßneubildung. Diese Versorgung mit neuen Blutgefäßen ist für viele Tumoren so wichtig, daß ein aktueller Therapieansatz darin besteht, proangiogenetische Faktoren wie VEGF-A mittels Antikörpern abzufangen.
Auf der Abbildung sieht man, wie der Wirkstoff Bevacizumab VEGF-A bindet und damit dessen proangiogenetische Funktion neutralisiert. So soll die Entstehung neuer Blutgefäße unterdrückt und der davon abhängige Tumor letztlich „ausgehungert“ werden.
Umgekehrt können Krebszellen aber auch die Expression von antiangiogenetischen Faktoren wie TSP-1, dessen Protein also das Wachstum und die Verzweigung von Gefäßen unterdrückt, vermindern, z.B. mittels des berühmt-berüchtigten Myc-Proteins, und so das oben erwähnte Gleichgewicht noch stärker in Richtung Gefäßneubildung auslenken.
Die Muster, Verteilungen und Ausbreitung der Gefäßneubildung unterscheiden sich bei den verschiedenen Tumorarten. In manchen, wie dem hochaggressiven Karzinom des Pankreasgangs finden sich sogar häufig regelrechte „Wüstengebiete“, die kaum oder überhaupt nicht mit Gefäßen versorgt sind, während andere, wie das Nierenkarzinom, hochgradig angiogen und daher mit Gefäßen dicht durchsetzt sind. Solche Beobachtungen legen nahe, daß nach einem initialen Anschieben der Gefäßneubildung während der Tumorentstehung Perioden mit sehr variabler angiogenetischer Intensität folgen, die wie von einem komplexen und tumorspezifischen „Schieberegler“ gesteuert werden können. Auf diesen können sowohl die Tumorzellen selbst Einfluss nehmen, als auch die Zellen ihrer Umgebung (sog. Mikroumgebung), welche eine bedeutende Rolle bei der Krebsentwicklung spielen.




Kommentare (6)