Ich habe neulich einen Forschungsaufsatz gelesen, der mir einen euphorischen “I fucking love science!“-Moment angesichts der heutigen Möglichkeiten und Synergien von Gen- und Informationstechnologie bereitete. Einer Gruppe von Forschern um M. Fussenegger ist es gelungen, eine Reihe von Apparaturen und Systemen zu konstruieren, mit denen ein Mensch kabellos, also über Entfernung, die Herstellung von Genprodukten im Inneren einer Maus durch seine Gedanken kontrollieren kann! Ernsthaft! Keine Science Fiction [1]. Wozu das gut sein soll, dazu später. Zunächst zum Wie:
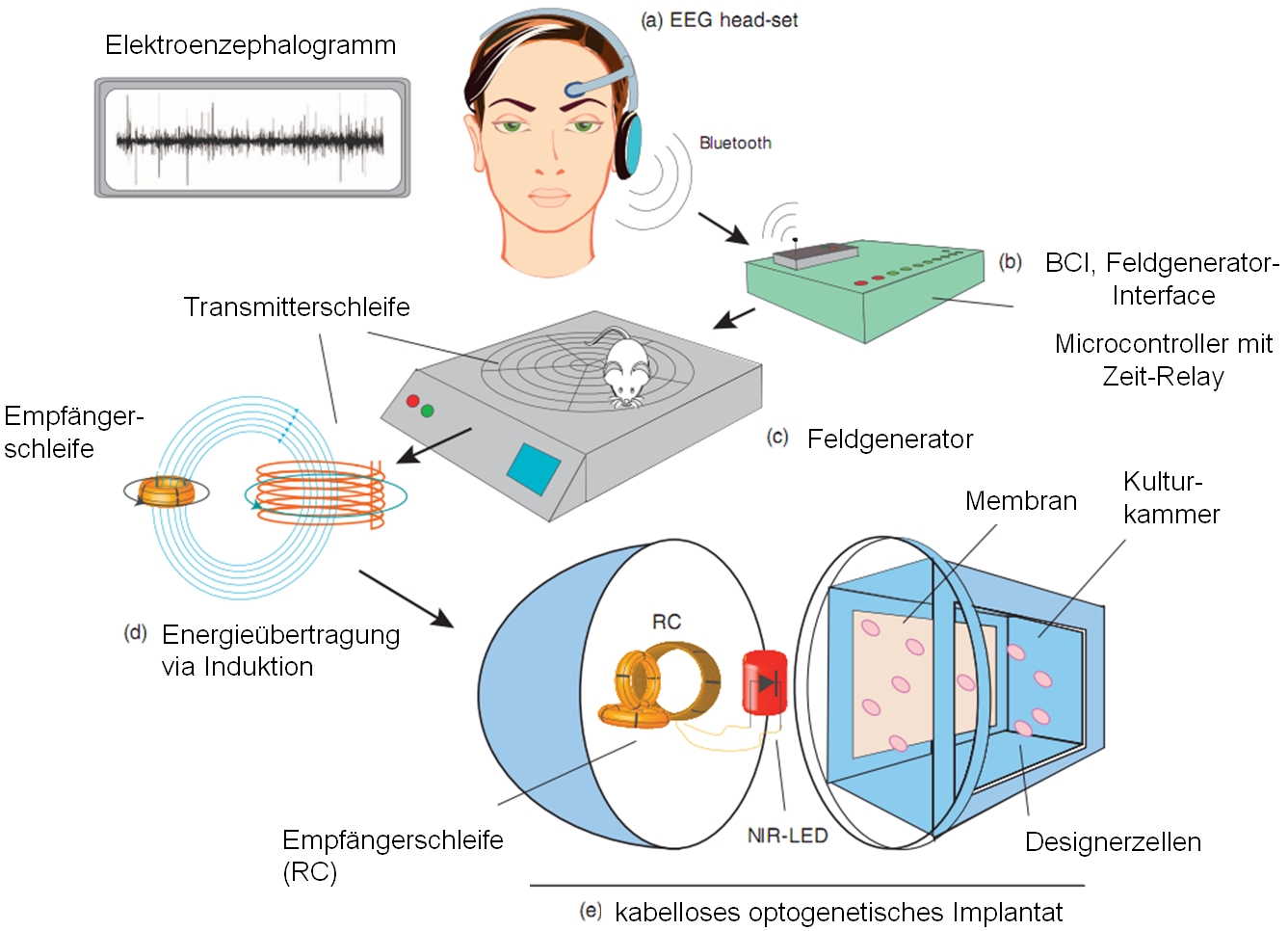
Menschlicher Teil: die Versuchsperson trägt ein EEG-Headset, mittels dessen ihre Gehirnströme gemessen und per Bluetooth an ein Hirn-Computer-Interface (BCI) weitergeleitet werden können. Bestimmte Hirnprozesse, z.B. Meditation, Konzentration oder Biofeedback, erzeugen so spezifische Hirnstrommuster, daß das BCI diese erkennen und als Signal für z.B. “Anschalten” interpretieren kann. An dieses BCI ist nun ein Feldgenerator angeschlossen, der auf ein Signal hin ein elektromagnetisches Feld erzeugen kann, durch das per Induktion Energie in Form von Strom in einem entsprechenden „Empfänger“ erzeugt wird.
Mausteil: die Maus sitzt und bewegt sich frei auf dem Feldgenerator. Sie trägt ein kabelloses Implantat in Form einer dünnen hohlen Röhre. Darin ist eine LED enthalten, die Licht im nahen Infrarotbereich (760–2500 nm Wellenlänge), sogenanntes NIR-Licht ausstrahlt, das sich durch hohe Gewebedurchdringung bei geringer ausgelöster Phototoxizität auszeichnet. Diese LED wird nun über Induktionsstrom aktiviert: sie ist der „Empfänger“ für die Energie aus dem Feld des Feldgenerators, auf dem die Maus sitzt. Das NIR-Licht der LED trifft dann auf genetisch veränderte menschliche Zellen in einer semipermeablen Kulturkammer, die sich ebenfalls im Implantat befindet.
Zellteil:
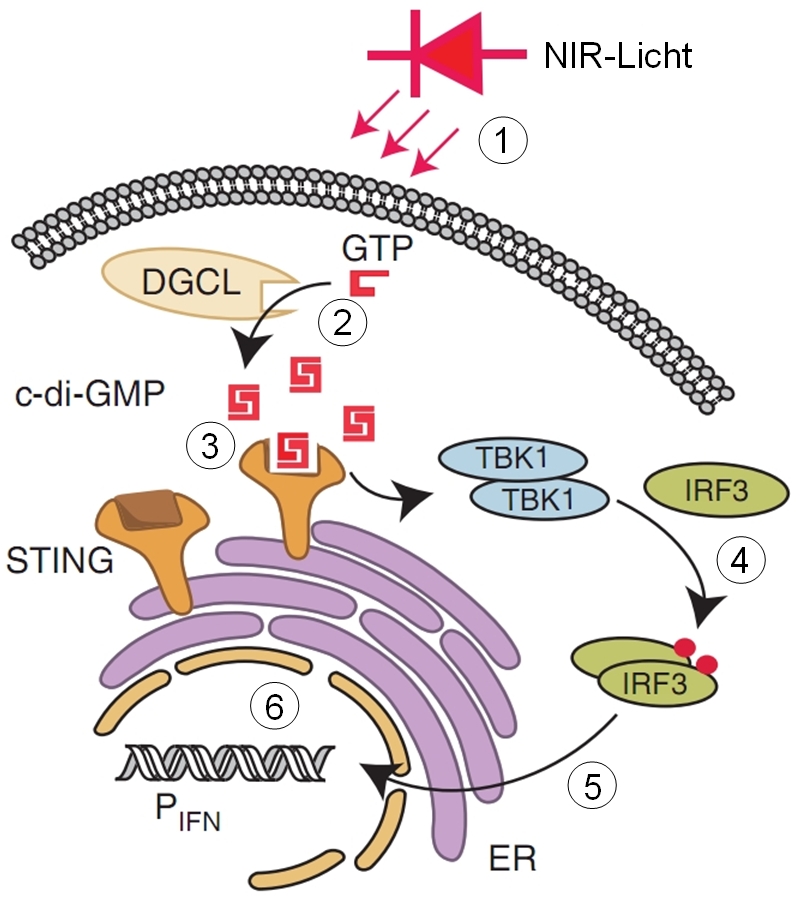
Die Zellen, die das NIR-Licht empfangen, tragen eine genetisch modifizierte und durch NIR-Licht aktivierbare, bakterielle Diguanylatcyclase (DGCL), ein Enzym, das die Umwandlung von Guanosintriphosphat (GTP) in das Signalmolekül cyclisches Diguanosinmonophosphat (c-di-GMP) katalysiert (2 in der Abbildung), die also c-di-GMP herstellt, wenn sie mit NIR-Licht beleuchtet (1 in der Abbildung) wird. c-di-GMP bindet dann an den „stimulator of interferon genes“ (STING) (3 in der Abbildung), ein Protein, das Teil der menschlichen angeborenen Immunkomponente ist und normalerweise die Freisetzung von c-di-GMP aus Krankheitserregern erkennt. Durch Bindung von c-di-GMP aktiviert, bewirkt STING über die tank-bindende Kinase 1 (TBK1) die Phosphorylierung des Interferon regulierenden Faktors 3 (IRF3) (4 in der Abbildung), der daraufhin in den Zellkern wandert (5 in der Abbildung) und dort an Typ-I-Interferon-Promotoren (PIFN) bindet (6 in der Abbildung).
Promotoren sind regulatorische Gensequenzen, von denen aus die Transkription gestartet, also die Expression eines Gens initiiert wird. Hinter diese Promotoren kann gentechnisch ein beliebiges Gen eingebaut werden. Im Fall der hier besprochenen Zellen war dies das Gen für die sezernierte alkalische Phosphatase (SEAP). Dieses Enzym wird von den Zellen ausgeschieden und kann das Implantat verlassen, den Blutstrom der Maus erreichen und dann im Blut nachgewiesen werden. Diese gesamte Kette, von der NIR-aktivierbaren DGCL über die Zwischenstufen bis zur Produktion von im Blut nachweisbaren SEAP nennt man „optogenetischen Schaltkreis“, da ein optisches Signal in die Expression eines bestimmten Gens umgsesetzt wird.
Die Gruppe um M. Fussenegger hat nun diese drei Systeme integriert und somit die Möglichkeit erschaffen, durch Gedanken die Expression eines Gens in einer Maus zu aktivieren:
Ein Mensch aktiviert per Hirnstrommuster einen Feldgenerator über ein BCI. Das Feld des Generators aktiviert per Induktion die NIR-LED im Implantat einer darauf sitzenden Maus. Das NIR-Licht aktiviert einen optogenetischen Schaltkreis im Implantat, an dessen Ende das SEAP-Gen exprimiert wird, wodurch SEAP hergestellt wird, durch die semipermeable Membran in der Kulturkammer diffundiert und schließlich im Blut der Maus nachweisbar ist.
Ist das nicht phantastisch?! Aber hat das ganze, außer unglaublich cool zu sein, auch einen Nutzen bzw. wofür kann man es in Zukunft gebrauchen?
Es bieten sich da z.B. therapeutische Ansätze für Patienten an, die unter dem Locked-In-Syndrom oder unter Epilepsie leiden. Solche Patienten sind chronisch oder akut handlungsunfähig, könnten aber mit Hilfe eines solchen Systems durch bewußte bzw. krankheitsbedingte Hirnstrommuster (z.B. spezifische Muster, die einem epileptischen Anfall vorausgehen) therapeutische Gene einschalten, deren Produkte dann beispielsweise schmerzlindernd oder einen Anfall coupierend oder sogar im Vorfeld verhindernd wirken könnten. Auch chronische Schmerzpatienten oder Depressive könnten zukünftig von dem Konzept profitieren, indem das System eine therapeutische Intervention aufgrund objektiver Messungen (nämlich bestimmter Hirnstrommuster) initiiert, ggf. noch bevor der Patient selbst merkt, daß sich eine Schmerzattacke oder ein depressiver Schub ankündigt. Es wäre zudem auch relativ leicht möglich, den Feldgenerator zu miniaturisieren und somit eine echt mobile Variante des Systems anzubieten.
Vielleicht spielt Genexpression durch Gedankenkontrolle also eine Rolle in der evidenzbasierten Pharmakotherapie der Zukunft mit durch meßbare Hirnzustände bestimmter Medikamentendosierung…
_______
Referenz:
[1] Folcher, M., Oesterle, S., Zwicky, K., Thekkottil, T., Heymoz, J., Hohmann, M., … & Fussenegger, M. (2014). Mind-controlled transgene expression by a wireless-powered optogenetic designer cell implant. Nature communications, 5.



Kommentare (11)